
【题目】有一稀硫酸和硝酸铁的混合溶液,向其中加入铁粉,溶液中的Fe2+浓度如图所示(不考虑溶液体积的变化):

(1)溶液中H2SO4与Fe(NO3)3的物质的量之比为_________
(2)请写出详细的计算过程_________。
【答案】2:1 加入铁粉,首先发生反应4H++ NO3-+ Fe = Fe3+ + NO↑ + 2H2O,NO3-消耗完后,继续发生反应2Fe3+ + Fe =3Fe2+,
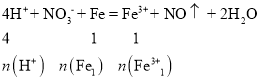 ,
,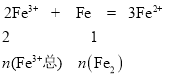 ,
,![]() ,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)= 4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。
,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)= 4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。
【解析】
加入铁粉,首先发生反应4H++ NO3-+ Fe = Fe3+ + NO↑ + 2H2O,NO3-消耗完后,继续发生反应2Fe3+ + Fe =3Fe2+,据此列比例计算。
加入铁粉,首先发生反应4H++ NO3-+ Fe = Fe3+ + NO↑ + 2H2O,NO3-消耗完后,继续发生反应2Fe3+ + Fe =3Fe2+,
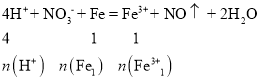 ,
,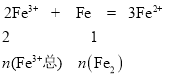
![]() ,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)=4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。
,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)=4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。


科目:高中化学 来源: 题型:
【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。
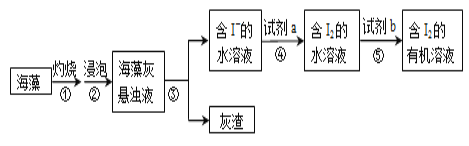
(1)③的操作名称是_______,所需的玻璃仪器有:_______⑤的操作名称是_______。
(2)试剂b可以是四氯化碳,还可以是_______(填名称)。选择四氯化碳的理由是:_____
(3)关于⑤的操作步骤,下列说法正确的是__________(填字母)。
A 振荡液体时,需要倒转分液漏斗
B 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D 分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:
_____I― +______H2O2+_________=_______I2+_________。(系数为“1”时,要写“1”)
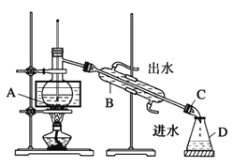
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
物质 | 熔点 | 沸点 |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,②图中有一个明显错误,应改正为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.Ba(OH)2溶液中滴加NaHSO4至完全沉淀:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.漂白粉的生产原理:2OH-+Cl2=Cl-+ClO-+H2O
C.二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O=4H++2Br-+SO42-
D.AlCl3溶液加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(____)两种物质都是非金属氧化物
(____)两种物质都是钠的化合物
(____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为________。
②证明有红褐色胶体生成的最常用的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
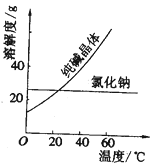
(2)阅读、分析下列两个材料:
材料一、(见图)
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下:![]() (g)
(g)![]()
![]() (g)+H2(g) ΔH = +117.6kJ·mol-1
(g)+H2(g) ΔH = +117.6kJ·mol-1
(1)往刚性恒容容器中同时通入乙苯和水蒸气,测得容器总压和乙苯转化率随时间变化结果如图所示。
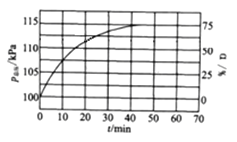
①平衡时,p(H2O)=_________,平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,请列式计算)
②下列说法正确的是_________
A.当混合气体的平均相对分子质量不再改变,反应达到平衡状态
B.增加通入水蒸气的量,有利于乙苯转化率的高
C.若将该反应置于恒压容器中反应,其他起始条件相同,乙苯的转化率将减小
D.仅往该刚性恒容容器中通入和上述等量的乙苯,其他条件相同,平衡时氢气的分压不变
(2)CO2气氛下乙苯催化脱氢可同时存在以下两种途径:

①请画出途径1的能量和反应过程的图像,并作适当标注______________

②途径I的反应历程如图所示,下列说法正确的是_________

A. CO2为氧化剂
B. 状态1到状态2形成了O-H键
C. 中间产物只有(![]() )
)
D. 该催化剂可提高乙苯的平衡转化率
③刚性容器中,在催化剂作用下,一定时间内p(CO2)与乙苯转化率关系如图分析,则p(CO2)为15kPa时,乙苯转化率最高的可能原因_________
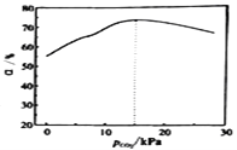
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
HCl:____________________;Ca(OH)2:_________________;
NH3·H2O:_________________;NH4NO3:_________________;
H2CO3:______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构模型的演变图如右,下列符合历史演变顺序的一组排列是

A. (1)(3)(2)(4) B. (1)(2)(3)(4)
C. (1)(4)(3)(2) D. (1)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是
A. 二氧化锰与浓盐酸加热反应:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 氯化镁溶液与氨水反应:Mg2++2NH3·H2O=Mg(OH)2↓+2NH
C. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-=Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com