
【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。
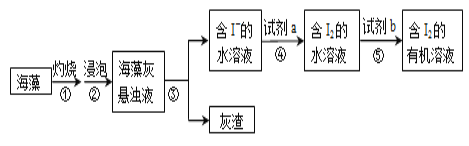
(1)③的操作名称是_______,所需的玻璃仪器有:_______⑤的操作名称是_______。
(2)试剂b可以是四氯化碳,还可以是_______(填名称)。选择四氯化碳的理由是:_____
(3)关于⑤的操作步骤,下列说法正确的是__________(填字母)。
A 振荡液体时,需要倒转分液漏斗
B 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D 分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:
_____I― +______H2O2+_________=_______I2+_________。(系数为“1”时,要写“1”)
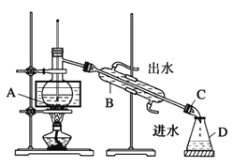
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
物质 | 熔点 | 沸点 |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,②图中有一个明显错误,应改正为_____________。
【答案】过滤 漏斗、 玻璃棒 、烧杯 萃取分液 苯或汽油 四氯化碳不溶于水,而I2在易溶于四氯化碳,且I2与四氯化碳不反应 A 2 1 2H+ 1 2H2O 冷凝管 温度计的水银球在蒸馏烧瓶的支管口处
【解析】
解答本题需要明确流程转化,根据流程转化分析对应的操作以及各步发生的反应,同时需要掌握萃取分液的操作过程等。
(1)操作③之后得到溶液和灰渣,因此该操作为过滤;过滤需要的玻璃仪器有烧杯、玻璃棒和漏斗;根据流程转化可知操作⑤为萃取分液;
(2)由于操作⑤为萃取分液,所以b可以是四氯化碳或苯或汽油等有机物溶剂,选择四氯化碳的理由为:四氯化碳不溶于水,而I2在易溶于四氯化碳,且I2与四氯化碳不反应;
(3)A 振荡液体时,需要倒转分液漏斗,A项正确;
B 充分振荡液体后,将分液漏斗放置在铁架台上,静置一段时间后分液,B项错误;
C 分液时,下层液体都要从分液漏斗下口沿着烧杯内壁流入烧杯,上层液体从上口倒出,C项错误;
D 分液时,为保证液体顺利下滴,应取下瓶塞,D项错误;
(4)碘元素化合价由-1价升高到0价,过氧化氢中的氧元素由-1价降低到-2价,根据化合价升降总数相等、质量守恒可得2I- +H2O2+2H+=I2+2H2O
(5)①根据装置图分析可知仪器B的名称为冷凝管;
②根据装置图可知图中有一个明显错误,应改正为温度计的水银球在蒸馏烧瓶的支管口处。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】C、H、O、N 是构成生命的基本元素,是中学化学研究的重要内容之一。
(1)对碳原子核外两个未成对电子的描述,正确的是_____
A. 电子云形状不同
B. 自旋方向相同
C. 能量不同
D. 在同一轨道
(2)C、O、N 三种元素第一电离能由大到小的顺序是_____
(3)HCHO 分子中碳原子轨道的杂化类型是_____,福尔马林(HCHO 的水溶液),HCHO 极易与水互溶的主要原因是_____
(4)在有机银镜反应实验中其中一种反应物是配合物,写出此配合物离子的结构简式_____,提供孤电子对的成键原子是_____。
(5)如图是金刚石晶胞,每个碳原子的配位数是_____;每个晶胞中含有的碳原子个数是_____;若晶胞的边长是anm,该晶胞中两个碳原子之间的最短距离为_____nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种可溶性物质,它们的阳离子可能分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能分别是NO3-、SO42-、OH-、CO32-中的某一种。
①若把4种物质分别溶解于盛有蒸馏水的4支试管中,均得澄清溶液,只有B溶液呈蓝色。
②若向①的4支试管中分别加盐酸,C溶液中有沉淀产生,A溶液中有无色无味气体逸出。
(1)根据①②的事实推断B、C的化学式分别为_________、_________。
(2)写出上述实验中C与盐酸的反应化学方程式:_________。
(3)将A溶液与D溶液混合使之恰好完全反应,将反应后混合物中两种物质分离的方法是_________。在所得溶液中加入铝片,发生的离子反应方程式为:_________。
(4)A与稀硫酸反应生成的气体x用排空法收集,测得体积为8.96 L(标准状况下),质量为15.2 g,该混合气体平均摩尔质量为_________,混合气体中x气体的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
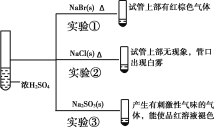
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某树脂的结构片断如图所示,下列关于该树脂的说法不正确的是( )(图中~~~表示链延长)
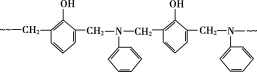
A.合成该树脂的反应为缩聚反应
B.理论上合成该树脂的原料比例相同
C.合成该树脂的单体之一甲醛可由甲醇氧化得到
D.该树脂难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向H2O2溶液中滴加少量Fe2(SO4)3溶液,反应原理如图所示。关于该反应过程的说法正确的是( )

A.该反应过程中,M是Fe3+,M′是Fe2+
B.当有1molO2生成时,转移2mo1电子
C.在H2O2分解过程中,溶液的pH逐渐降低
D.H2O2的氧化性比Fe3+强,还原性比Fe2+弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
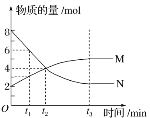
A. 化学方程式:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一稀硫酸和硝酸铁的混合溶液,向其中加入铁粉,溶液中的Fe2+浓度如图所示(不考虑溶液体积的变化):

(1)溶液中H2SO4与Fe(NO3)3的物质的量之比为_________
(2)请写出详细的计算过程_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com