
对于任何一个化学平衡体系,以下变化或采取的措施,平衡一定发生移动的是
①加入一种反应物,②增大体系的压强,③升高温度,④使用催化剂,⑤化学平衡常数减小.
A.①②③⑤ B.①②③④⑤
C.③⑤ D.①②③
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
在一密闭容器中,反应aA(g) 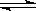 bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.物质B的质量分数增加了
D.a >b
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:实验题

(1)写出下列仪器的名称:a:__________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是_____________,将仪器补充完整后进行实验,冷凝水由___________(填f或g)口通入。
(3)现需配制0.lmol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是________________。除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有:_____________。
②根据计算得知,需称量NaOH的质量为_________g。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______ ______。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④下列操作使配制的NaOH溶液浓度偏低的有_________。
A.称量氢氧化钠时间过长 B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
在标准状况下,mg气体A与ng气体B的分子数相同,下列说法中不正确的是( )
A.两种气体A与B的相对分子质量之比为m:n
B.同质量气体A与B的分子数之比为n:m
C.同温同压下,A、B两气体的密度之比为n:m
D.相同状况下,同体积A、B两气体的质量之比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
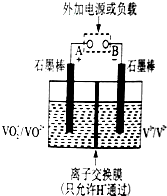 钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ/mol | |
| B. | 2SO2+O2?2SO3;△H=-196.6 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g);△H=+393.5 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com