
科目:高中化学 来源:广西南宁沛鸿民族中学2010-2011学年高二下学期期中考试化学文科试题 题型:013
|
往2 L密闭容器中充入8.0 mol气态反应物A,2 min后,测得A还剩余2.0 mol,则2 min内A的化学反应速率为 | |
| [ ] | |
A. |
1.0 mol/(L·min) |
B. |
1.5 mol/(L·min) |
C. |
2.0 mol/(L·min) |
D. |
3.0 mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源:浙江省余姚中学2011-2012学年高二下学期第一次质检化学试题 题型:022
工业合成氨与制备硝酸一般可连续生产,流程如下:
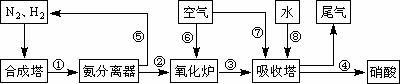
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)![]() CO2+H2.t℃时,往1 L密闭容器中充入0.2 mol CO和0.3 mol水蒸气.反应建立平衡后,体系中c(H2)=0.12 mol·L-1.该温度下此反应的平衡常数K=________(填计算结果).
CO2+H2.t℃时,往1 L密闭容器中充入0.2 mol CO和0.3 mol水蒸气.反应建立平衡后,体系中c(H2)=0.12 mol·L-1.该温度下此反应的平衡常数K=________(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1________300℃(填“>”、“<”或“=”).
2NH3(g) ΔH<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1________300℃(填“>”、“<”或“=”).
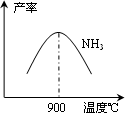
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因________.
(4)在上述流程图中,氧化炉中发生反应的化学方程式为________.
(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________.
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为________.
查看答案和解析>>
科目:高中化学 来源:福建省厦门六中2011-2012学年高二下学期期中考试化学试题 题型:022
工业合成氨与制备硝酸一般可连续生产,流程如下:
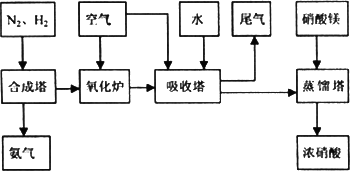
(1)工业生产时,制取氢气的一个反应为:CO+H2O![]() CO2+H2,
CO2+H2,
①t℃时,往1 L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol·L-1,该温度下此反应的平衡常数K=________;(请填数字不必带单位)
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=________.
(2)合成塔中发生反应为:
N2(g)+3H2(g)![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0
下表为不同温度下该反应的平衡常数.由此可推知,表中T1________573K(填“>”、“<”或“=”).
在生产中,若要增大H2的转化率,在其他条件不变的情况下可以采取的措施为________(填字母).
A.加入一定量H2
B.加入一定量N2
C.将生成的气体NH3液化分离
D.升高温度
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2![]() 4NO+6H2O;△H=-905 kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因________.
4NO+6H2O;△H=-905 kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因________.

(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是________
2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是________
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)工来合成氨与制备硝酸一般可连续生产,流程如下:
(1)工来生产时,制取氢气的一个反应为:![]() ,
,
①t℃时,往l L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol?L-1,该温度下此反应的平衡常数K= ;
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率![]() (H2O)= 。
(H2O)= 。
T(K) | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)合成塔中发生反应为:
![]()
![]()
 右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
![]() 4NH3+5O2
4NH3+5O2![]() NO+6H2O AH=-905kJ?mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因 。
NO+6H2O AH=-905kJ?mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因 。
![]() (4)吸收塔中反应为:3NO2+H2O
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
![]() (5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
![]() CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ![]() H=-574kJ?mol-1。;
H=-574kJ?mol-1。;
![]() CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ![]() H=-1160 kJ?mol-1;
H=-1160 kJ?mol-1;
则甲烷直接将NO2还原为N2的热化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com