
【题目】试确定下列物质的一氯代物和二氯代物的同分异构体
|
| |
名称 | 楞晶烷 | 篮烷 |
一氯代物 | ______ | ______ |
二氯代物 | ______ | ______ |
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列做法值得提倡的是
A.小苏打用作净水剂B.“地沟油”加工为生物燃料
C.饮高度酒预防新冠肺炎D.漂粉精作食品漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同主族元素氢化物的稳定性,自上而下逐渐增强
B.电子结构相同的微粒,它们的化学性质亦相同
C.元素Si、P、S、C1最高价含氧酸的酸性依次增强
D.同周期的短周期元素自左而右原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,电极反应为:
溶液,电极反应为:![]() ,
,![]() 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。

①下列叙述正确的是_______。
![]() .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极
![]() .使用过程中,电子由
.使用过程中,电子由![]() 极经外电路流向
极经外电路流向![]() 极
极
![]() .
.![]() 是负极,
是负极,![]() 是正极
是正极
![]() .
.![]() 电极发生还原反应,
电极发生还原反应,![]() 电极发生氧化反应
电极发生氧化反应
②写出电池的总反应式:________________________________________________________________ 。
③使用时,电解质溶液的![]() ________。
________。
(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是 _____________________________________________________________________;
②电解液中![]() 的浓度将变_______;
的浓度将变_______;
③当外电路通过![]() 电子时,理论上负极板的质量增加_______
电子时,理论上负极板的质量增加_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
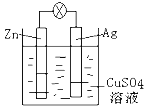
①Zn电极是_______(填“正极”或“负极”),反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),电极反应式为__________。
(2)甲醇(CH3OH)是一种重要的化工原料,在生产中有着重要的应用。甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示:(质子交换膜可以通过H+)
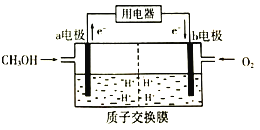
通入甲醇气体的电极为电池的_____(填“正”或“负")极,电解质溶液中H+向_____电极移动(填“a"或“b")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的的化学方程式为________________。
(2)反应开始至2分钟时,B的平均反应速率为_________。
(3)下列措施能使该反应加快的是_______(仅改变一个条件)。
a.降低温度 b.缩小容积 c.使用效率更高更合适的催化剂
(4)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成n mol B的同时生成2n mol C
②单位时间内生成n mol B的同时生成2n mol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(5)由图求得平衡时A的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com