
【题目】某反应在体积为5L的恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的的化学方程式为________________。
(2)反应开始至2分钟时,B的平均反应速率为_________。
(3)下列措施能使该反应加快的是_______(仅改变一个条件)。
a.降低温度 b.缩小容积 c.使用效率更高更合适的催化剂
(4)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成n mol B的同时生成2n mol C
②单位时间内生成n mol B的同时生成2n mol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(5)由图求得平衡时A的转化率为__________。
【答案】2A + B2C 0.1 mol·(L·min)1 bc ①③⑤⑦ 40%
【解析】
(1)反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,根据物质的量的变化判断计量数之间的关系;
(2)根据![]() 计算以气体Y表示的平均反应速率;
计算以气体Y表示的平均反应速率;
(3)根据影响反应速率的因素分析;
(4)根据平衡标志分析。
(5) A的转化率=A的变化量÷A的初始量×100%。
(1)由图象可知, C的物质的量逐渐增多,A、B的物质的量逐渐减少,则A、B为反应物,C为生成物,在相等的时间内A、B、C的物质的量变化之比为2:1:2,所以反应方程式应为:2A + B2C;
(2) ![]() 0.1 mol·(L·min)1;
0.1 mol·(L·min)1;
(3)根据影响反应速率的因素,a.降低温度反应速率减慢; b.缩小容积,压强增大, 反应速率加快; c.使用效率更高更合适的催化剂,反应速率加快;故选bc。
(4)①单位时间内生成n mol B的同时生成2n mol C,可知正逆反应速率相等,一定达到平衡状态,故选①;
②单位时间内生成n mol B的同时生成2n mol A,都是逆反应速率,不一定平衡,故不选②;
③2A + B2C反应前后气体物质的量是变量,容器体积不变,所以压强是变量,容器内压强不再随时间而发生变化,一定达到平衡状态,故选③;
④任意时刻以C、A、B的物质的量浓度变化表示的反应速率的比都为2:2:1,所以不一定平衡,故不选④;
⑤混合气体的颜色不再改变,说明A的浓度不变,一定达到平衡状态,故选⑤;
⑥混合气体的总质量不变、容器体积不变,根据![]() ,混合气体的密度是恒量,混合气体的密度不再改变,不一定平衡,不选⑥;
,混合气体的密度是恒量,混合气体的密度不再改变,不一定平衡,不选⑥;
⑦达到平衡状态时正逆反应速率之比等于系数比,所以v逆(A)=v正(C)达到平衡状态,故选⑦。
(5) A的转化率=A的变化量÷A的初始量×100%=2÷5×100%=40%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。下列说法正确的是
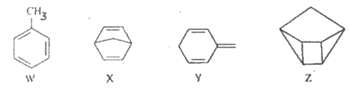
A. Z的一氯代物只有3种
B. 化合物W的同分异构体只有X、Y、Z
C. X、Y、Z均可与酸性KMnO4溶液反应
D. 1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请认真阅读下列三个反应:
①![]()
![]()
![]()
②![]()
![]()
![]() (-NH2易被NaClO氧化)
(-NH2易被NaClO氧化)
③2![]()
![]()

利用这些反应,按以下步骤可从某烃A合成一种染料中间体DSD酸。(试剂和条件已略去)
A![]() B
B![]() CD
CD![]()
请写出A、B、C、D的结构简式。
A:_____________________________________;
B:_____________________________________;
C:_____________________________________;
D:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1gH2和4gO2混合点燃,充分反应,放出71.45kJ热量,同样条件下1molH2在O2中完全燃烧放出的热量是
A.71.45kJB.142.9kJC.571.6kJD.285.8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | |||
三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
四 | ||||||||
(1)写出下列元素符号;②_______、_______;表中在室温下呈液态的单质,其化学式为________.
(2)表中元素⑦的原子结构示意图为____________;元素⑤的离子结构示意图为_________;元素与元素两者核电荷数之差是_______
(3)分别写出元素⑨的最高价氧化物的水化物与元素⑦、的最高价氧化物的水化物反应的化学方程式_________________________________;________________________.
(4)分别写出③与、与⑥组成的化合物的电子式__________;_________
(5)用电子式表示①与⑩组成的化合物的形成过程______________________
(6)表中元素⑩和最高价氧化物对应水化物的酸性:______>_____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间的加成反应,反应产物一定为纯净物的是
A. CH3-CH=C(CH3)2+Br2→
B. CH2=CH-CH2-CH3+HCl![]()
C. CH3-CH=CH2+H2O![]()
D. nCH2=CH2+nCH2=CH-CH3![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com