
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | |||
三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
四 | ||||||||
(1)写出下列元素符号;②_______、_______;表中在室温下呈液态的单质,其化学式为________.
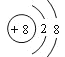
(2)表中元素⑦的原子结构示意图为____________;元素⑤的离子结构示意图为_________;元素与元素两者核电荷数之差是_______
(3)分别写出元素⑨的最高价氧化物的水化物与元素⑦、的最高价氧化物的水化物反应的化学方程式_________________________________;________________________.
(4)分别写出③与、与⑥组成的化合物的电子式__________;_________
(5)用电子式表示①与⑩组成的化合物的形成过程______________________
(6)表中元素⑩和最高价氧化物对应水化物的酸性:______>_____(写化学式)。
【答案】Li O Br2 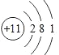
 18 Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3HClO4=Al(ClO4)3+3H2O
18 Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3HClO4=Al(ClO4)3+3H2O 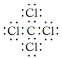
![]()
![]() HClO4 H2SO4
HClO4 H2SO4
【解析】
由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为Al、⑩为S、为Cl、为Ar、为K、为Ca、为Br、为Kr;再结合元素周期律解题。
由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为Al、⑩为S、为Cl、为Ar、为K、为Ca、为Br、为Kr;
(1)由分析可知②锂元素,元素符号为Li;为氧元素,元素符号为O;溴为唯一的液态非金属单质,其化学式为Br2;
(2)元素⑦为Na,其原子结构示意图为 ;元素⑤为O,O2-的离子结构示意图为
;元素⑤为O,O2-的离子结构示意图为 ;元素为Ar,核电荷数为18,元素为氪,核电荷数为36,两者核电荷数之差是18;
;元素为Ar,核电荷数为18,元素为氪,核电荷数为36,两者核电荷数之差是18;
(3)元素⑨为Al,其最高价氧化物的水化物是Al(OH)3;元素⑦为Na,其最高价氧化物的水化物为NaOH;为Cl,其最高价氧化物的水化物为HClO4,Al(OH)3分别与NaOH、HClO4反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O;
(4)③为C、为Cl,两者组成的化合物为CCl4,共价化合物,则CCl4的电子式为![]() ;为Ca、⑥为F,两者组成的化合物为CaF2,为离子化合物,则CaF2的电子式为
;为Ca、⑥为F,两者组成的化合物为CaF2,为离子化合物,则CaF2的电子式为![]() ;
;
(5)①为H、⑩为S,两者组成的化合物为H2S,H2S为共价化合物,则其电子式的形成过程为![]() ;
;
(6)元素⑩为S、为Cl,非金属性Cl>S,则最高价氧化物对应水化物的酸性HClO4>H2SO4。


科目:高中化学 来源: 题型:
【题目】(1)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
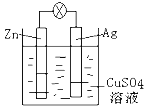
①Zn电极是_______(填“正极”或“负极”),反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),电极反应式为__________。
(2)甲醇(CH3OH)是一种重要的化工原料,在生产中有着重要的应用。甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示:(质子交换膜可以通过H+)
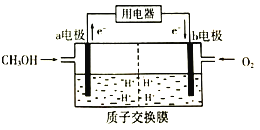
通入甲醇气体的电极为电池的_____(填“正”或“负")极,电解质溶液中H+向_____电极移动(填“a"或“b")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的的化学方程式为________________。
(2)反应开始至2分钟时,B的平均反应速率为_________。
(3)下列措施能使该反应加快的是_______(仅改变一个条件)。
a.降低温度 b.缩小容积 c.使用效率更高更合适的催化剂
(4)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成n mol B的同时生成2n mol C
②单位时间内生成n mol B的同时生成2n mol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(5)由图求得平衡时A的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:![]()
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是________,转Mg(OH)2化为MgCl2的离子方程式是____________。
②由无水MgCl2制取Mg的化学方程式是________________________。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
![]()
①灼烧海带时所用的主要仪器名称是________________。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式_______________________。
反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.短周期是指第1、2周期B.过渡元素全部是金属元素
C.元素周期表有8个副族D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
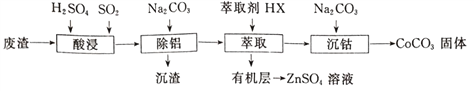
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com