
(16分)实验室模拟合成氨和氨催化氧化的流程如下:
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式 。从下图中选择制取氮气的合适装置 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 。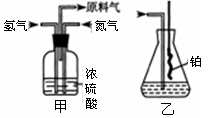
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、 离子。
(1)NaNO2 + NH4Cl NaCl + N2↑+2H2O a
NaCl + N2↑+2H2O a
(2)干燥气体控制氢气和氮气的流速(3)说明氨的氧化反应是一个放热反应;有红棕色气体产生
(4)NH4+、NO3-
解析试题分析:(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气, 该反应的化学方程式为:NaNO2 + NH4Cl NaCl + N2↑+2H2O。该反应为液+液
NaCl + N2↑+2H2O。该反应为液+液 气体。所以应该选择a装置。(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有控制氢气和氮气的流速,以调节二者的混合比例及对气体进行干燥处理。(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是氨的氧化反应是一个放热反应。氨氧化的方程式为4NH3+5O2
气体。所以应该选择a装置。(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有控制氢气和氮气的流速,以调节二者的混合比例及对气体进行干燥处理。(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是氨的氧化反应是一个放热反应。氨氧化的方程式为4NH3+5O2 4NO+6H2O;产生的NO在锥形瓶上方遇空气发生反应:2NO+ O2= 2NO2产生红棕色的NO2气体。因此锥形瓶中还可观察到的现象是有红棕色气体产生。(4)产生的NO2在水中溶解发生反应3NO2+ H2O == 2HNO3+ NO得到硝酸,硝酸与氨气发生反应得到NH4NO3.因此反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+、NO3-。
4NO+6H2O;产生的NO在锥形瓶上方遇空气发生反应:2NO+ O2= 2NO2产生红棕色的NO2气体。因此锥形瓶中还可观察到的现象是有红棕色气体产生。(4)产生的NO2在水中溶解发生反应3NO2+ H2O == 2HNO3+ NO得到硝酸,硝酸与氨气发生反应得到NH4NO3.因此反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+、NO3-。
考点:考查实验室制取氮气的实验原理、操作及氨气的催化氧化的现象、溶液中含有的成分的确定的知识。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:填空题
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、CaCO3、H2O外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的操作方法是:
_________________________________________________________________。
(4)若过滤I的滤液中的Ca2+浓度低于1.0×10-5 mol·L-1时可认为被沉淀完全。若要使Ca2+沉淀完全,则滤液中CO32-离子的物质的量浓度不得低于 。
(已知:Ksp(CaCO3)=5.0×10-9)
(5)写出蒸氨过程中的化学方程式 。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)硫酸锌被广泛应用于工农业生产和医药领域。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下: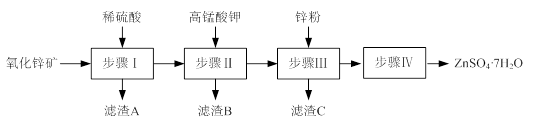
⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
⑶步骤Ⅲ所得滤渣C的主要成分是 。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。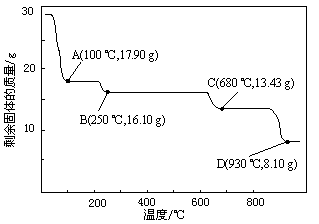
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②680 ℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
A除去SO2气体 B除去空气中的水蒸气 C有利于气体混合
D有利于观察空气流速 E除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)="0.01" mol?L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol?L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是 。
副产品A的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
[14分]实验室制备苯乙酮的化学方程式为:
制备过程中还有
 等副反应。
等副反应。
主要实验装置和步骤如下:
(I)合成:在三颈瓶中加入20 g无水AlCl3和30 mL无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6 mL乙酸酐和10 mL无水苯的混合液,控制滴加速率,使反应液缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器a的名称:____________;装置b的作用:________________________________。
(2)合成过程中要求无水操作,理由是____________________________________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_________________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种: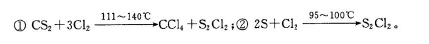 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: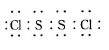 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: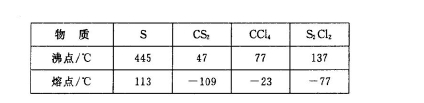
实验室利用下列装置制备 (部分夹持仪器已略去):
回答下列问题:
(1)写出A装置中发生反应的离子方程式
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中 实验。
| A.石油分馏 | B.制备乙烯 | C.制取乙酸乙酯 | D.制取溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:□ClO3- +□FeS2+□H+=□ClO2+□Fe3++□SO42-+□H2O
(2)装置D的作用是 。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:
回答下列问题:
①操作Ⅰ的名称为: 。
②试剂X是 ,写出发生的主要反应的离子方程式 。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为 。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用如图装置探究氯气和氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:
(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): 。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com