
利用如图装置探究氯气和氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:
(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): 。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:
(15分)(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
(3)(见右图) (3分)
(3分)
(4)3Cl2+8NH3=6NH4Cl+N2;3∶2 (各2分);取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀 (2分)
(5)将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中(1分)
解析试题分析:(1)F装置是制备氯气的,浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)装置A是制备氨气的,氨水中存在电离平衡NH3·H2O NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应该选择饱和食盐水;水蒸气常用浓硫酸除去,因此正确的连接是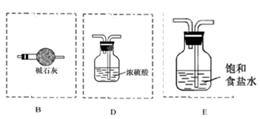 。
。
(4)在C中观察到大量白烟,同时产生一种气体单质,白烟应该是氯化铵,单质应该是氮气。这说明氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,反应的化学方程式是8NH3+3C12=6NH4C1+N2;根据方程式可知,氮元素的化合价从-3价升高到0价,氯元素的化合价从0价降低到-1价,所以根据电子的得失守恒可知,反应中氧化剂与还原剂的物质的量比为3∶2;氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+。
(5)氯气属于大气污染物,需要尾气处理,正确的的操作应该是将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中。
考点:考查氯气和氨气的制备;气体的净化与尾气处理;离子的检验以及氧化还原反应方程式的书写和计算等


科目:高中化学 来源: 题型:实验题
(16分)实验室模拟合成氨和氨催化氧化的流程如下:
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式 。从下图中选择制取氮气的合适装置 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 。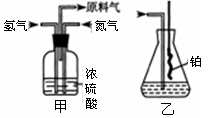
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、 离子。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: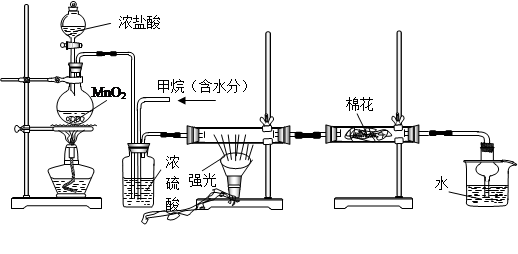
A B C D E
(1)写出A装置中发生反应的离子方程式
(2)B装置主要有三种功能:① ② ③均匀混合气体;
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的值应≥
(4)D装置中棉花上均匀滴有足量淀粉KI浓溶液,其作用是 ,一段时间后发现
棉花由白色变为 色。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式 。
(6)E装置中使用球形干燥管的作用是
(7)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填字母)。
| A.分液法 | B.蒸馏法 | C.过滤 | D.结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。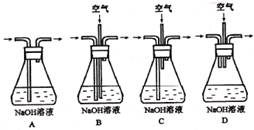
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_ ;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E. Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。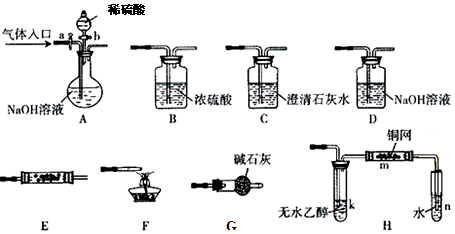
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
市售氯化钾中所含杂质以Na+、Mg2+为主,也含有少量SO42—、Fe3+等。提纯过程如下:
(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣a的主要成分是 ;滤渣b的主要成分是 。
(3)检验BaCl2溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,进一步提纯的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验现象和解释或结论都正确的选项是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com