
【题目】苯酚是一种重要的化工原料.以苯酚为主要起始原料,某种药物中间体的合成路线如图: 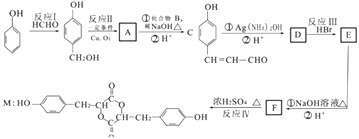
已知① ![]()
②本题不考虑酚羟基与银氨溶液的中和反应
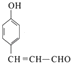
(1)C中含氧官能团的名称为;化合物 B的名称是
(2)上述合成路线中属于加成反应的有处.
(3)写出下列化学方程式
C与银氨溶液反应
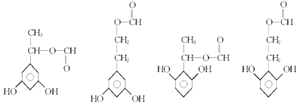
(4)满足下列条件的 F的同分异构体的结构简式有种.
①苯环上有三个取代基且苯环上的一氯取代物只有两种.
②能与FeCl3溶液发生显色反应.
③红外光谱显示有 HCOO﹣结构.
【答案】
(1)醛基和酚羟基;乙醛
(2)2
(3) +2Ag(NH3)2OH
+2Ag(NH3)2OH ![]()
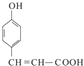 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
(4)
【解析】解:(1)C中含氧官能团的名称为醛基和酚羟基;化合物B为CH3CHO,B的名称是乙醛,所以答案是:醛基和酚羟基;乙醛;(2)上述合成路线中属于加成反应的有2处,所以答案是:2;(3)C生成D的方程式为 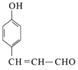 +2Ag(NH3)2OH
+2Ag(NH3)2OH ![]()
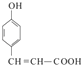 +2Ag↓+3NH3+H2O,所以答案是:
+2Ag↓+3NH3+H2O,所以答案是: 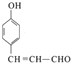 +2Ag(NH3)2OH
+2Ag(NH3)2OH ![]()
 +2Ag↓+3NH3+H2O;(4)F(
+2Ag↓+3NH3+H2O;(4)F( ![]() )的同分异构体下列满足:
)的同分异构体下列满足:
①苯环上有三个取代基且苯环上的一氯取代物只有两种,有2个相同的取代基,且为对称结构,②能与FeCl3溶液发生显色反应,说明含有酚羟基,③红外光谱显示有 ![]() ,可能的结构简式为:
,可能的结构简式为: 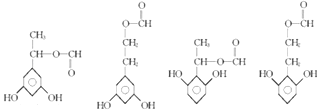 ,所以答案是:
,所以答案是: 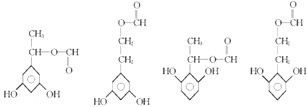 .
.


科目:高中化学 来源: 题型:
【题目】屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( ) 
A.分子式为C15H24O2
B.属子芳香族化合物
C.能发生取代反应和加成反应
D.分子中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下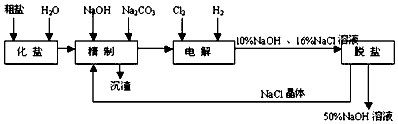
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是 , .
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ , 该钡试剂可以是
A.Ba(OH)2
B.Ba(NO3)2
C.BaCl2
(3)电解过程中所发生反应的化学方程式为 , 与电源正极相连的电极附近产生的气体是 , 检验该气体可使用试纸,现象是试纸变为色.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下: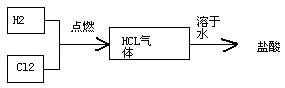
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是 . 合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97% .
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为 .
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显色,往B试管中通入干燥的氯化氢气体,试纸显色.最后向C试管中加入物质(填化学式),他之所以加入这种物质的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲分子式为C11H14O2 , 在酸性条件下水解生成乙和丙,丙遇FeCl3溶液显紫色,丙的相对分子质量比乙大20,甲的结构有( )
A.6种
B.4种
C.3种
D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A.1gH2 和 8gO2
B.150℃、1.01×105Pa 时,18LH2O和 18LCO2
C.0.1 molHCl和2.24LHe
D.标准状况下,2.24LCCl4和6.02×1022个CO分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ![]() .
. 
醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
(1)B中含碳官能团的结构式为 , C的名称是 .
(2)反应①的有机反应类型是 .
(3)下列说法正确的是(填字母编号).
a.1mol E与足量的银氨溶液反应能生成2mol Ag
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4)写出E与新制的氢氧化铜悬浊液反应的化学方程式;
(5)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有种.
的同分异构体中同时符合下列条件的芳香族化合物共有种.
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(6)写出反应⑤的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳里含量占第一、第二位元素之间形成的化合物不具有的性质是( )
A. 熔点高,硬度大B. 常温下能与烧碱溶液反应
C. 高温下能与生石灰反应D. 能与水蒸气反应生成酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知测定中和热的实验步骤如下:
①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因 .
(2)加入NaOH溶液的正确操作是__________(填字母).
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 .
(4)设溶液的密度均为1gcm﹣3 , 中和后溶液的比热容c=4.18J(g℃)﹣1 , 请根据实验数据求出中和热为 ,写出该反应的热化学方程式 .
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
(5)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量(填“小于”、“等于”或“大于”)57.3kJ,原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com