
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
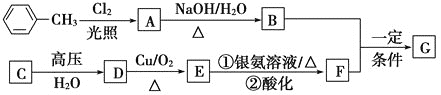
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________。
A生成B的化学方程式:__________________。
(4)符合下列条件的G的同分异构体有________种。
a.苯环上有3个取代基,且有两个取代基相同;
b.能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为________、________。
【答案】![]() 取代反应 加成反应 2CH3CH2OH+O2
取代反应 加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O 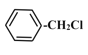 +NaOH
+NaOH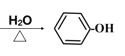 +NaCl 6
+NaCl 6 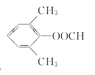
【解析】
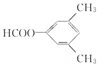
C的产量可用来衡量一个国家的石油化工发展水平,则C为CH2=CH2,与水发生加成反应生成D为CH3CH2OH,D发生催化氧化生成E为CH3CHO,E与银氨溶液发生氧化反应生成F为CH3COOH,甲苯与氯气在光照条件发生甲基上的取代反应生成A,A发生水解反应生成B,B与F反应生成G(C9H10O2),由G的分子式可知,B为一元醇,故A为![]() ,B为
,B为![]() ,G为
,G为![]() ,据此解答。
,据此解答。
C的产量可用来衡量一个国家的石油化工发展水平,则C为CH2=CH2,与水发生加成反应生成D为CH3CH2OH,D发生催化氧化生成E为CH3CHO,E与银氨溶液发生氧化反应生成F为CH3COOH,甲苯与氯气在光照条件发生甲基上的取代反应生成A,A发生水解反应生成B,B与F反应生成G(C9H10O2),由G的分子式可知,B为一元醇,故A为![]() ,B为
,B为![]() ,G为
,G为![]() ;
;
(1)由分析可知G的结构简式为![]() ;
;
(2)A转化为B属于水解反应,反应类型为取代反应;C转化为D属于加成反应;
(3)D发生催化氧化生成E为CH3CHO的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;A发生水解反应生成B的化学方程式为
2CH3CHO+2H2O;A发生水解反应生成B的化学方程式为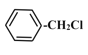 +NaOH
+NaOH +NaCl;
+NaCl;
(4)符合下列条件的![]() 的同分异构体:能够与新制的银氨溶液反应产生光亮的银镜,含有-CHO,苯环上有3个取代基,且有两个取代基相同,还含有2个-CH3,2个-CH3相邻,-CHO有2种位置,2个-CH3处于间位,-CHO有3种位置,2个-CH3处于对位,-CHO有1种位置,故符合条件的同分异构体有2+3+1=6种,其中氢原子共有四种不同环境的所有物质的结构简式为:
的同分异构体:能够与新制的银氨溶液反应产生光亮的银镜,含有-CHO,苯环上有3个取代基,且有两个取代基相同,还含有2个-CH3,2个-CH3相邻,-CHO有2种位置,2个-CH3处于间位,-CHO有3种位置,2个-CH3处于对位,-CHO有1种位置,故符合条件的同分异构体有2+3+1=6种,其中氢原子共有四种不同环境的所有物质的结构简式为: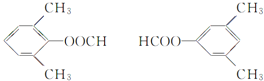 。
。


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】现有反应:
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2![]() 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
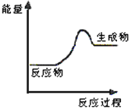
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
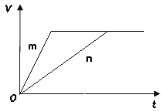
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c(![]() )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
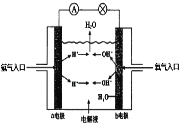
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则![]() 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图,下列说法不正确的是( )
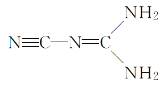
A.该分子与水分子可以形成氢键
B.该分子中原子最外层均达到8电子稳定结构的为C、N
C.1mol该物质中σ键和π键的个数比为5:3
D.该分子中C原子的杂化方式有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:
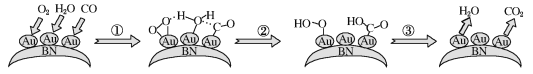
下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
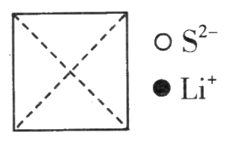
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI与Cu(NO3)2的反应,进行实验一:
实验一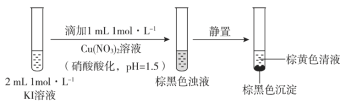
注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL______溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,![]() 氧化了I-。
氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除____________氧化I-的可能性。
③若要确证实验一中是![]() 氧化了I-,应在实验一的基础上进行检验______的实验。
氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b._________吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二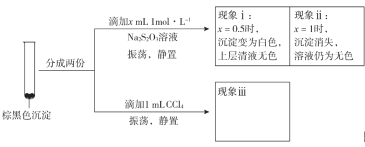
已知:CuI难溶于CCl4;I2+![]() ==2I-+
==2I-+![]() (无色);Cu++S2O32-==
(无色);Cu++S2O32-==![]() (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为______________。
③用化学平衡移动原理解释产生现象ii的原因:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com