
【题目】汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,温度不同(T2>T1)、其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,温度不同(T2>T1)、其他条件相同时,下列图像正确的是



A B C D
科目:高中化学 来源: 题型:
【题目】肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)101kPa,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。肼—空气燃料电池放电时其负极的电极反应式是 。
(3)如右图是一个电化学过程示意图。
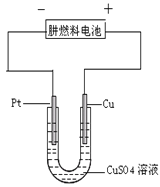
①铂片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程的电源,铜片质量变化128g,则肼—空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气的体积含量为20%)。
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
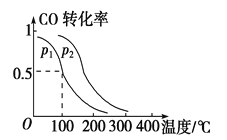
① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
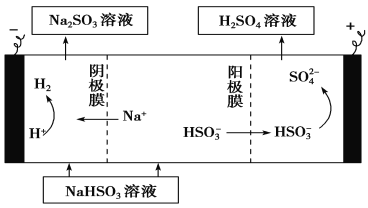
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 物质发生化学变化不一定伴随着能量变化
B. 硫酸钡、醋酸铵、氨水都是弱电解质
C. 用Na2S溶液与AlCl3溶液混合制取Al2S3
D. 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
B.1mol甲烷燃烧生成水蒸汽和二氧化碳所放出的热量是甲烷燃烧热
C.已知由石墨制备金刚石为吸热反应,则金刚石比石墨稳定
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为___________________;
(2) GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式_______________。
(3)下列有关镓和镓的化合物的说法正确的是____________
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为____ _。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是________________________。
(6)净化II中加入Zn的目的是_______________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3]=8.0×10-38;lg5=0.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,探究氯碱工业原理,下列说法正确的是

A.石墨电极与直流电源负极相连
B.铜电极的反应式为:2H++2e-=H2↑
C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移
D.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制取氯化硫酰( SO2Cl2):SO2(g)+Cl2(g)![]() SO2C12(l) △H<0,在恒压密闭容器中,加入1mol SO2和1mol Cl2,反应达到平衡后,当其他条件不变时,下列说法正确的是( )
SO2C12(l) △H<0,在恒压密闭容器中,加入1mol SO2和1mol Cl2,反应达到平衡后,当其他条件不变时,下列说法正确的是( )
A.再加入1mol SO2和1mol Cl2,重新达到平衡后,Cl2浓度和原平衡时相等
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.通入Ar气,使容器压强增大,可同时提高SO2和Cl2的转化率
D.分离出部分SO2Cl2,正反应速率增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A(g)+B(g) ![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________反应(填“吸热”、“放热”)。
②当反应达到平衡时,升高温度,A的转化率___________(填“增大”、“减小”或“不变”),原因是___________________
(2)(6分)把3molA和2.5molB混合,充入2L密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),经5秒钟反应达到平衡,生成1 molD,并测得C的平均反应速率为0.1mol·L-1·s-1,则此反应中B的转化率为 ,C的化学计量数x为 ,A的平衡浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com