
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
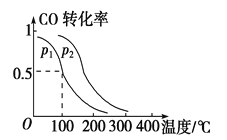
① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
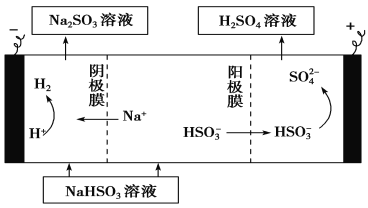
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。
【答案】(1)2ΔH3+ΔH2-ΔH1
(2)①B、大于②4(mol/L)-2
(3)①SO2+2H2O-2e-=SO![]() +4H+②HSO
+4H+②HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+
+3H+
【解析】
试题分析:(1)已知:①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1 kJ·mol-1;
②CO(g)+1/2O2(g)=CO2(g) ΔH2 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3 kJ·mol-1。
根据盖斯定律:②+③×2-①得则CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
ΔH=2ΔH3+ΔH2-ΔH1 kJ·mol-1。
(2)① A.随着反应的进行,容器内气体的质量保持不变,容器的容积保持不变,密度不随反应的进行而变化,若容器内气体密度恒定,不能说明反应达到平衡状态,错误;B.若容器内各气体浓度恒定,反应达到平衡状态,正确;C.分析图像知,升高温度,CO的平衡转化率减小,平衡逆向移动,则上述反应中,ΔH < 0 ,错误;D.反应中,催化剂,平衡不移动,错误,选B;②由图像可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)![]() CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强p2大于p1;③利用三行式计算。100℃时,
CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强p2大于p1;③利用三行式计算。100℃时,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L)0.5 1 0
转化浓度(mol/L)0.25 0.5 0.25
平衡浓度(mol/L)0.25 0.5 0.25
该反应的化学平衡常数K=c(CH3OH)/c2(H2)c(CO)=4 (mol/L) - 2。
(3)①该原电池中,负极上二氧化硫失电子被氧化生成硫酸,利用氢离子和水配平电荷和原子,负极上的电极反应式为SO2+2H2O-2e-=SO![]() +4H+。②电解池中阳极和电源正极相连,亚硫酸氢根失去电子,发生氧化反应生成硫酸,利用氢离子和水配平电荷和原子,阳极电极反应式是HSO
+4H+。②电解池中阳极和电源正极相连,亚硫酸氢根失去电子,发生氧化反应生成硫酸,利用氢离子和水配平电荷和原子,阳极电极反应式是HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+。
+3H+。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2+2C+2Cl2═TiCl4+2CO
(1)指出该反应的氧化剂 ,氧化产物 ;
(2)用双线桥法标出电子转移;
(3)当有6mol电子转移,则有 mol还原剂被氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
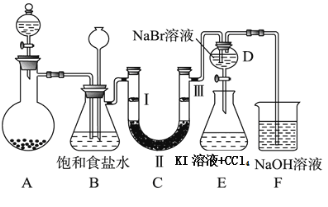
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: 。装置B中饱和食盐水的作用是 ;
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(3)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式: 。
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期,第________族。
(2)下列推断正确的是________。
A.单质的还原性:Tl>Al
B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3
D.氧化性:Tl3+>Al3+
(3)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子
B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱
D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质递变不正确的是
A. 酸性: HClO4>H2SO4>H3PO4
B. 半径:Cl-> Na+>F-
C. 热稳定性:HF> H2O> PH3
D. 还原性:Cl- < Br-< I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离的c(H+)=1×10-11mol/L-1,该溶液中的溶质可能是( )
①二氧化硫水溶液②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
A. ①④ B. ①② C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
B.39 g Z2Y2中含有的离子数约为1.204×1024
C.元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐
D.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,温度不同(T2>T1)、其他条件相同时,下列图像正确的是
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,温度不同(T2>T1)、其他条件相同时,下列图像正确的是



A B C D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H =-196 kJ/mol
2SO3(g) △H =-196 kJ/mol
请填空:(填>、=、<;增大、减小、不变)
(1)当容器体积不变,①向容器中充入1mol SO2和0.5mol O2,②向容器中充入1mol SO3。两种情况下反应分别达到平衡后,放出和吸收的热量分别为Q1和Q2,则Q1+Q2____________98KJ。
①中达到平衡后,再向容器中加入1mol SO2和0.5mol O2,重新达到平衡,O2体积分数___________。
②中达到平衡后分离出部分SO3,重新平衡后,SO3的浓度________。
(2)保持压强不变,①向容器中充入1mol SO2和0.5mol O2,②向容器中充入1mol SO3,反应达到平衡时,SO2和O2的转化率前者________后者;再向容器中充入1mol SO2和0.5mol O2,重新达到平衡后,SO2的浓度________、O2物质的量_________原平衡的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com