
【题目】常温下,某溶液中由水电离的c(H+)=1×10-11mol/L-1,该溶液中的溶质可能是( )
①二氧化硫水溶液②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
A. ①④ B. ①② C. ②③ D. ③④
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,18 g重水(D2O)所含的中子数为10NA
B.100℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+
C.71g氯气发生氧化还原反应,一定失去2NA个电子
D.室温下,14gN2和CO的混合气体中含有的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期主族元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
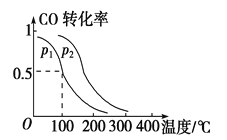
① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。
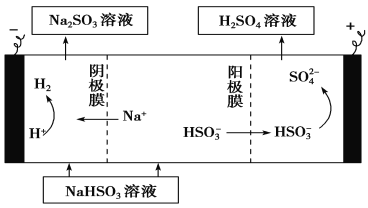
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在指定溶液中一定能大量共存的是
A.加入Al能放出H2的溶液中:Fe2+、K+、NO![]() 、Cl-
、Cl-
B.在pH=13的溶液中:Na+、AlO2-、NO![]() 、S2-、SO
、S2-、SO![]()
C.由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、NO![]() 、NH
、NH![]() 、F-
、F-
D.NaHCO3溶液中:K+、Na+、SO![]() 、Al3+
、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 物质发生化学变化不一定伴随着能量变化
B. 硫酸钡、醋酸铵、氨水都是弱电解质
C. 用Na2S溶液与AlCl3溶液混合制取Al2S3
D. 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为___________________;
(2) GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式_______________。
(3)下列有关镓和镓的化合物的说法正确的是____________
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为____ _。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是________________________。
(6)净化II中加入Zn的目的是_______________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3]=8.0×10-38;lg5=0.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有着“植物大熊猫”和世界上最长寿树种美称、在地球上己有250万年历史的红豆杉,入选2010年世博会中国馆珍稀植物展出品种,其体内含量最多的化学元素和最基本的化学元素分别是
A. C 和 0 B. C 和 H C. 0 和 C D. H 和 C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com