
【题目】能够鉴别BaCl2溶液、NaCl溶液、Na2CO3溶液的试剂是
A.AgNO3溶液
B.稀硫酸
C.稀盐酸
D.稀硝酸
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则混合物中碳酸钠的质量为( )
A.3.38g
B.4.58g
C.4.16g
D.4.41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应,(假设容器不参加反应)。若过滤后滤渣能被磁铁吸引,则溶液中不可能有( )
A.Fe3+
B.Fe2+和Cu2+
C.Fe3+和Cu2+
D.Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
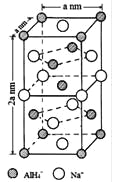
(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂,NaH属于 晶体,其电子式为 。
(3)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的一种离子和一种分子 、 (填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有 个;NaAlH4晶体的密度为 gcm-3(用含a的代数式表示).若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(5)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,分子中有两个配位键,蒸气分子的结构式为 (标明配位键)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构.这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤后的食盐水中仍然含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序为
A.③②①⑤④
B.①②③⑤④
C.②③①④⑤
D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系,其中①②③均为有单质参与的反应。
![]()
(1)若A是常见的金属,①③中均有同一种气态非金属单质参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式________。
(2)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是______,写出反应①的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修5—有机化学基础】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示: 已知以下信息:
①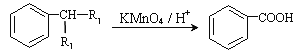
②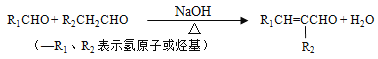
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图II所示
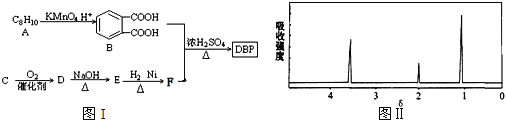
请根据以上信息回答下列问题:
(1)C的结构简式为 , E中所含官能团的名称是 ;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F: ;
②B和F以物质的量比1︰2合成DBP: ,该反应的反应类型为 。
(3)同时符合下列条件的B的同分异构体有 种,写出其中任意两种同分异构体的结构简式 。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体.根据题意下列结论不正确的是( )
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0molL﹣1 400mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法或操作中,正确的有( )
①标准状况下,1 mol溴单质的体积约为22.4 L ②用托盘天平称量50.56 g KCl固体 ③用酒精从饱和碘水中萃取碘
④让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路” ⑤从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法
A. 1个 B. 2个
C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com