
| A、①②④⑤ | B、③④ |
| C、③④⑤ | D、②③⑤ |


科目:高中化学 来源: 题型:
| 太阳能 |
| ① |
| 900℃ |
| ② |
A、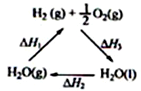 图中△H1=△H2+△H3 |
| B、该过程实现了太阳能向化学能的转化 |
| C、该过程中CeO2没有消耗 |
| D、H2O(l)=H2O(g)此过程中,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
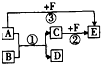 已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )
已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )| A、A中的官能团是羟基 |
| B、反应①为取代反应,反应②为置换反应 |
| C、B能与CaCO3反应 |
| D、B与F不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 绿矾 |
| H+ |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子价电子排布式为:nsnnpn+1 |
| Y | Y原子的最外层电子数是次外层的三倍 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com