
| 元素 | 相关信息 |
| X | X的基态原子价电子排布式为:nsnnpn+1 |
| Y | Y原子的最外层电子数是次外层的三倍 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
| ||
| ||


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、①②④⑤ | B、③④ |
| C、③④⑤ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
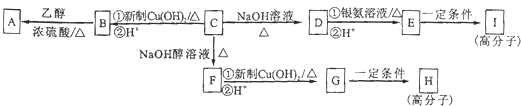
查看答案和解析>>
科目:高中化学 来源: 题型:
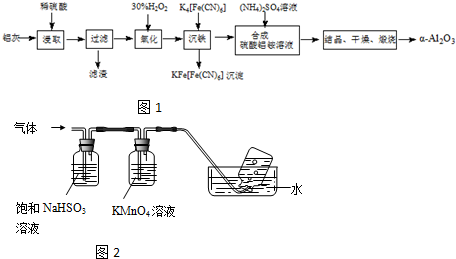
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
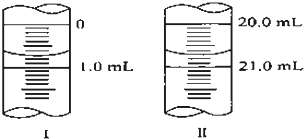 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
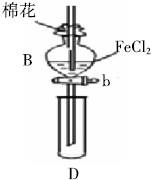 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用标准的NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液---浅红色 |
| B、用标准FeCl3溶液滴定KI溶液以测定其浓度:淀粉溶液---蓝色 |
| C、用标准酸性KmnO4溶液滴定Na2SO3溶液以测定其浓度:KmnO4溶液---紫红色 |
| D、利用“Ag++SCN═AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液---红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B、通入SO2气体后的溶液:Na+、Ca2+、K+、Cl- |
| C、0.1 mol?L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| D、1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸,沉淀全部溶解 |
| D、向盛有FeCl2溶液的试管中滴加NaOH溶液,最终生成红褐色的Fe(OH)3沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com