
����Ŀ����Ϣɸѡ��
��.ij����(NiO)��������FeO��Al2O3��MgO��SiO2�����ʣ��ô˷�����ȡNiSO4�Ĺ���������ͼ1��ʾ��
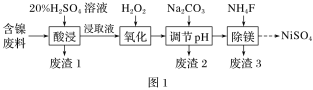
��֪����SiO2������ϡ���ᡣ
��Ksp(MgF2)��7.4��10��11��
���йؽ���������������������������pH��ͼ2��ʾ��
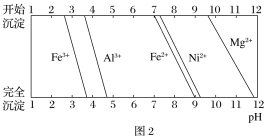
(1)��Na2CO3������Һ��pH��5���õ�����2����Ҫ�ɷ���_______________(�ѧʽ)��
(2)Mg���뱥��NH4Cl��Һ��Ӧ����NH3�����û�ѧƽ���ƶ�ԭ�����Խ��ͣ�___(�ñ�Ҫ�����ֺ����ӷ���ʽ�ش�)��
(3)��֪����ǰ��Һ��c(Mg2��)��1.85��10��3 mol��L��1������þ�ʴﵽ99%ʱ����Һ��c(F��)��_________mol��L��1��
(4)��NaOH��Һ����NaClO��NiSO4��Ӧ���Ƶ�NiO(OH)����ѧ����ʽΪ______��
�ζ�����һ����Ҫ�Ķ�������������Ӧ�÷�Χ�ܹ㡣ʵ���ҿ�ͨ���ζ��ķ����ⶨ������������Ʒ�Ĵ���(���ʲ����뷴Ӧ)���ⶨ�������£���֪��Ag����SCN��=AgSCN��(��ɫ)��
(1)��ȡ2.000g�Ʊ�����������Ʒ����ˮ�ܽ⣬���ݵ�100mL����Һ���ƹ��� �����õIJ����������ձ������������_____________________________��
(2)ȷ��ȡ25.00mL��Һ���ữ����뼸����立�[NH4Fe(SO4)2]��Һ��ָʾ��������0.100mol��L��1NH4SCN����Һ�ζ����ζ��յ��ʵ������Ϊ__________��
(3)���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ������и�������ʧ������������������������________(����ƫ������ƫ��������������)��
���𰸡�Fe(OH)3��Al(OH)3 NH4Clˮ�����H����NH4+��H2O![]() NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2�� 2.0��10��4 2NiSO4��NaClO��4NaOH=2Na2SO4��NaCl��2NiO(OH)��H2O 100mL����ƿ����ͷ�ι� ����һ�α���Һ����Һ��Ϊ��ɫ����30���ڲ���ɫ ƫ��
NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2�� 2.0��10��4 2NiSO4��NaClO��4NaOH=2Na2SO4��NaCl��2NiO(OH)��H2O 100mL����ƿ����ͷ�ι� ����һ�α���Һ����Һ��Ϊ��ɫ����30���ڲ���ɫ ƫ��
��������
����(NiO)��������FeO��Al2O3��MgO��SiO2�����ʣ����������SiO2����ӦΪ����1������ɷ�ת��ΪFe2+��Al3+��Mg2+��ȡ���Һ������H2O2��Fe2+������ΪFe3+������̼���Ƶ�����Һ���ȣ����ݳ���ͼ���֪������2Ϊ��������������������
(1)���ݳ���ͼ���֪����Na2CO3������Һ��pH��5ʱ��Fe3+��Al3+����ȫ�������õ�����2����Ҫ�ɷ���Fe(OH)3��Al(OH)3��
(2)Mg���뱥��NH4Cl��Һ��Ӧ����NH3��NH4Clˮ�����H����NH4+��H2O![]() NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2����
NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2����
(3)��֪![]() ������þ�ʴﵽ99%ʱ��������Ϊ��ȫ����ʱ����Һ��c(F��)��
������þ�ʴﵽ99%ʱ��������Ϊ��ȫ����ʱ����Һ��c(F��)��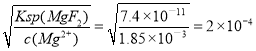 mol��L��1��
mol��L��1��
(4)��������ԭ��Ӧԭ����֪��2NiSO4��NaClO��4NaOH=2Na2SO4��NaCl��2NiO(OH)��H2O��
�� (1)������Һʱ������Ҫ�IJ�����������Ͳ��100mL����ƿ����ͷ�ιܡ�
(2) ��֪��ӦΪAg����SCN��=AgSCN��(��ɫ)����ζ����յ�ʱ����Һ�е�SCN����ʣ�࣬����立�[NH4Fe(SO4)2]��Һ�е�Fe3+��Ӧ��Һ��Ϊ��ɫ������Ϊ����һ�α���Һ����Һ��Ϊ��ɫ����30���ڲ���ɫ��
(3)���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ������и�������ʧ����ζ������еı�Һʵ������ƫ����������������������ƫ�ߡ�


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
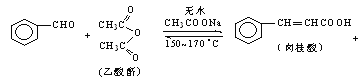
����Ŀ������������ϡ���ױƷ��ҽҩ�����Ϻй���֬�ȵ���Ҫԭ�ϣ�ʵ���������з�Ӧ��ȡ����ᣮ
 CH3COOH
CH3COOH
ҩƷ��������
����ȩ | ������ | ����� | ���� | |
�ܽ�ȣ�25�棬g/100gˮ�� | 0.3 | ����ˮˮ�� | 0.04 | ���� |
�е㣨�棩 | 179.6 | 138.6 | 300 | 118 |
��գ�
�ϳɣ���Ӧװ����ͼ��ʾ����������ƿ���Ⱥ������ϸ����ˮ�����ơ�����ȩ������������ʹ֮��Ͼ��ȣ� ��150��170�����1Сʱ��������״̬��
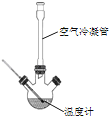
��1�����������ܵ�������__��
��2����װ�õļ��ȷ�����__�����Ȼ���Ҫ���Ʒ�Ӧ����״̬��������ҷ��ڣ��ᵼ���������ʽ��ͣ����ܵ�ԭ����______��
��3�������ô����ƾ��壨CH3COONa3H2O����ԭ����______��
��Ʒ���ƣ���������Ӧ��õ��Ļ������ȵ���Բ����ƿ�У��������в�����
��Ӧ�����![]()
![]()
![]()
![]()
![]() ����ᾧ��
����ᾧ��
��4���ӱ���Na2CO3��Һ����ת�����ᣬ��ҪĿ����_______��
��5������I��__������������ᾧ������Ȼ�����ʣ�����ߴ��ȿ��Խ��еIJ�����__������������ƣ���
��6�����ʵ�鷽�������Ʒ���Ƿ��б���ȩ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ��ʾ��һ������װ�ã�ͼ�еĴ�����__________________��
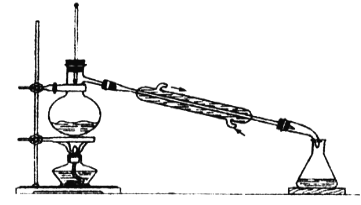
��2����������ķ���������ͣ��е�290�棩��ˮ�Ļ��������������������___________�����¶ȼ����жϸ������ѱ���ȫ������������______________��
��3����������ķ��������![]() ���е�Ϊ76.8�棩�к��е�����
���е�Ϊ76.8�棩�к��е�����![]() ���е�Ϊ45�棩��Ӧ�����¶���______________��
���е�Ϊ45�棩��Ӧ�����¶���______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��ʯī���缫�����ϡ��Na2SO4��Һ��װ�ã�ͨ�����ʯī�缫A��B�����ֱ�μ�һ��ʯ����Һ�������й�������ȷ����
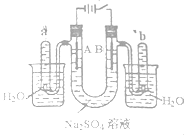
A���ݳ�����������A�缫��С��B�缫��
B��һ�缫�ݳ���ζ���壬��һ�缫�ݳ��̼�����ζ����
C��A�缫�����ʺ�ɫ��B�缫��������ɫ
D�����һ��ʱ���ȫ�����Һת�Ƶ�ͬһ�ձ��У���ֽ�����ܽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
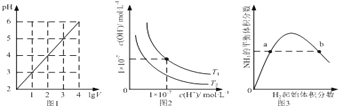

A.ͼ1��ʾ1 L pH=2��CH3COOH��Һ��ˮϡ����V L��pH��lgV�ı仯
B.ͼ2��ʾ��ͬ�¶���ˮ��Һ��H+��OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2��T1
C.ͼ3��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��b��N2��ת����С��a��
D.ͼ4��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2BaO2��s��![]() 2BaO��s��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
2BaO��s��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؼ����ڿ��ˣ�
(1)��AgNO2��AgCl�ı�����Һ�������Ϻ�����������������Һ�����ɵij���n(AgNO2)________n(AgCl)(��������������С��������������)������֪���¶��£�Ksp(AgNO2)��2��10��8��Ksp(AgCl)��1.8��10��10��
(2)CaSO3��Һ��CaCl2��Һ��ϻ��������ܵ�CaSO3(Ksp��3.1��10��7)���ֽ��������CaCl2��Һ��Na2SO3��Һ��ϣ������ǰNa2SO3��ҺŨ��Ϊ2��10��3 mol��L��1�������ɳ�������CaCl2��Һ����СŨ��Ϊ__________________��
ѧ���⣺ͨ������ڣ�2���ʵļ��㣬��˼�������ܶȻ�������Ksp�����ж������㣬��������Ũ��ʱ��Ҫע��Ĺؼ���ʲô��__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�IJ����У��е���ͬ���칹�壬�е�û��ͬ���칹�壬����һ��������ͬ���칹��ķ�Ӧ��(����)
A. �����ϩ(![]() )������ʵ�����Br2�����ӳɷ�Ӧ
)������ʵ�����Br2�����ӳɷ�Ӧ
B. 2-�ȶ������Ҵ���Һ���ȷ�����ȥ���ӵķ�Ӧ
C. �ױ���һ�������·���������Ӧ����һ�����ױ��ķ�Ӧ
D. ���ǻ���������NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ڳ��ʱ�����أ��ŵ�ʱ��ԭ��أ���ͼ��Ǧ���صĹ���ʾ��ͼ���䷴Ӧԭ��Ϊ��PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O����˵���д������(����)
2PbSO4+2H2O����˵���д������(����)

A.b�缫�ŵ��ת��Ϊc�缫
B.�缫a��d��������ԭ��Ӧ
C.b�ĵ缫��Ӧʽ��Pb+SO42����2e-��PbSO4
D.�ŵ��������Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λ��ѧ�����о�﮵�����������Թ������2019��ŵ������ѧ�������������(LiFePO4)����������ӵ���������ϣ��������ȶ��Ժá�ѭ��������������ȫ�Ըߵ��ص㣻��ΪĿǰ�㷺ʹ�õ�﮵�ء�
��1����Ԫ����Ԫ�����ڱ��е�λ��__��LiFePO4��Fe2+��̬�����Ų�ʽ��__��
��2��P�ĵ縺��___O�ĵ縺�ԣ���д�����ڡ���С�ڡ����ڡ�����PO43-�Ŀռ乹����__������ԭ�ӵ��ӻ���ʽ��___��
��3��Li+��H-������ͬ�ĵ��ӹ��ͣ�r(Li+)С��r(H-)��ԭ����__��
��4��FeCl3�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��Ӵ��ڵ�FeCl3�ĽṹʽΪ__������Fe����λ��Ϊ__��
��5����һ����ɫ����[�ɱ�ʾΪ��KFex(CN)6����Է�������ΪMr]�����о����֣��侧����![]() ��ͼ��ʾ��K+δ��������
��ͼ��ʾ��K+δ��������
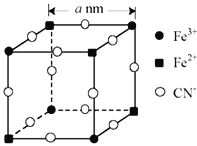
�پ�������ÿ��Fe3+��������ҵȾ����CN-��__����
�ڸþ���Ļ�ѧʽΪ__��
����������ÿ��Fe3+��Fe2+������anm��ʾ��������ܶȱ���ʽ��__g/cm3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com