
【题目】关键环节考核:
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知该温度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________________。
学法题:通过上题第(2)问的计算,请思考利用溶度积常数(Ksp)进行定量计算,代入离子浓度时需要注意的关键是什么?__________
【答案】大于 6.2×10—4 mol/L 该时刻溶液中离子的浓度,溶液等体积混合时,浓度需要减半。
【解析】
溶液沉淀平衡常数为Ksp,对于某沉淀溶解平衡:MmAn(s)![]() mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,Ksp越小,越容易沉淀。两溶液混合后,平衡向着更难溶的沉淀方向移动,据此回答问题。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,Ksp越小,越容易沉淀。两溶液混合后,平衡向着更难溶的沉淀方向移动,据此回答问题。
(1)已知该温度下,Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10,在AgCl和AgNO2饱和溶液中, c(NO2-)> c(Cl-),当将AgCl、AgNO2两饱和溶液混合时,平衡向着更难溶的方向移动,产生AgCl沉淀。加入足量的浓AgNO3溶液时,AgCl沉淀有所增多,但溶液中c(NO2-)大,产生的AgNO2沉淀更多;
(2) ![]() =3.1×10-7,等体积混合后SO32-溶液浓度为1×10-3 mol·L-1,生成沉淀时
=3.1×10-7,等体积混合后SO32-溶液浓度为1×10-3 mol·L-1,生成沉淀时![]() ,即混合前所需CaCl2溶液的最小浓度为6.2×10—4 mol/L。解题中需要注意:两溶液等体积混合,混合后溶质的物质的量浓度是混合前的一半。
,即混合前所需CaCl2溶液的最小浓度为6.2×10—4 mol/L。解题中需要注意:两溶液等体积混合,混合后溶质的物质的量浓度是混合前的一半。


科目:高中化学 来源: 题型:
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s) △H=-Q kJ/mol。
KCl(l)+NaAlSi3O8(s) △H=-Q kJ/mol。
(1)写出Cl原子的核外电子排布式_______, NaCl的熔点比KCl______ (选填“高”或“低”)。
(2)指出钾长石中存在的化学键类型__________________。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下:
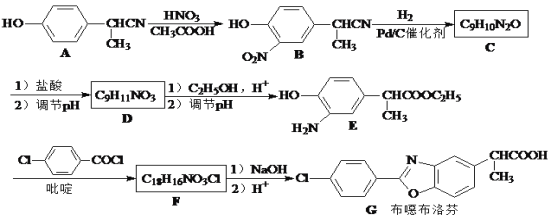
请回答下列问题:
(1)A长期暴露在空气中会变质,其原因是____。
(2)B→C反应类型为___________,E→F反应中生成的无机产物为_________。
(3)由A到B的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多,最可能生成的二硝基取代物是下列物质中的__________(填字母)。
a  b
b 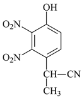 c
c 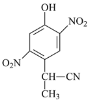 d
d 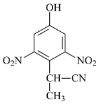
(4)D的结构简式__________;D的同分异构体H是一种α-氨基酸,能使FeCl3溶液显紫色,而且苯环上只有两个取代基,它在苯环上的一卤代物只有两种,则H的结构简式是 _________。
(5)写出以![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任选)_______________。合成路线流程图示例如下:CH2=CH2
的合成路线流程图(无机试剂任选)_______________。合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息筛选:
Ⅰ.某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
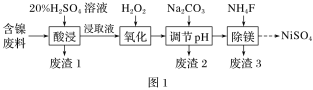
已知:①SiO2不溶于稀硫酸。
②Ksp(MgF2)=7.4×10-11。
③有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
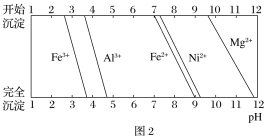
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是_______________(填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理加以解释:___(用必要的文字和离子方程式回答)。
(3)已知沉淀前溶液中c(Mg2+)=1.85×10-3 mol·L-1,当除镁率达到99%时,溶液中c(F-)=_________mol·L-1。
(4)在NaOH溶液中用NaClO与NiSO4反应可制得NiO(OH),化学方程式为______。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。实验室可通过滴定的方法测定所制硝酸银样品的纯度(杂质不参与反应),测定过程如下,已知:Ag++SCN-=AgSCN↓(白色)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程 中所用的玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(2)准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100mol·L-1NH4SCN标准溶液滴定。滴定终点的实验现象为__________。
(3)若滴定前滴定管尖嘴处有气泡,滴定过程中该气泡消失,则所测硝酸银的质量分数________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
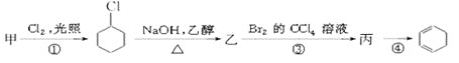
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火。实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃)。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为___g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①求25℃时KCl的溶解度___;
②求原混合物中KClO3的质量___;
③所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为多少___?(保留2位小数)
(3)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
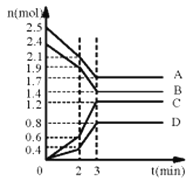
回答下列问题:
①该反应的化学方程式为___。
②前2min用A的浓度变化表示的化学反应速率为__。在2min时,图像发生改变的原因可能是__(填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式__,达到平衡时N2O4的转化率为__。
②在0~20s内,四氧化二氮的平均反应速率为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com