
【题目】工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
【答案】0.14 77.8% 87.4吨 3:1
【解析】
(1)氨气恰好完全氧化为一氧化氮,发生反应4NH3+5O2→4NO+6H2O,氨气和氧气物质的量之比为4:5,即氨气和空气物质的量之比为4:(5÷0.2)=4:25,由此可求出氨气的含量;
(2)由方程式可得反应总方程式:NH3+2O2=HNO3+H2O,为使1mol氨气恰好完全转化化为硝酸,所得硝酸溶液中HNO3与H2O的物质的量之比为1:1,由此可求出HNO3的质量分数;
(3)设用17吨NH3可制取质量分数为0.63的硝酸溶液质量是xmol,可利用N原子守恒建立关系式,NH3——HNO3,从而求出生成硝酸的质量;
(4)反应2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=48g,反应NO+NO2+Na2CO3=2NaNO2+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=32g,实际溶液质量增重40g,上述两个反应都发生,然后设未知数,列方程求解。
(1)氨气恰好完全氧化为一氧化氮,发生反应4NH3+5O2→4NO+6H2O,氨气和氧气物质的量之比为4:5,即氨气和空气物质的量之比为4:(5÷0.2)=4:25,所以氨气所占体积分数即物质的量分数为![]() =0.14,故答案为:0.14;
=0.14,故答案为:0.14;
(2)由方程式可得反应总方程式:NH3+2O2=HNO3+H2O,为使1mol氨气恰好完全转化化为硝酸,所得硝酸溶液中HNO3与H2O的物质的量之比为1:1,故所得硝酸溶液质量分数=77.8%,故答案为:77.8%;
(3)设用17吨NH3可制取质量分数为0.63的硝酸溶液质量是xmol,则:
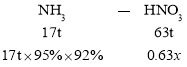
解得x=87.4t,故答案为:87.4t;
(4)反应2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=48g,反应NO+NO2+Na2CO3=2NaNO2+CO2↑,产生22.4L(标准状况下)CO2时,溶液质量增重△m=32g,实际溶液质量增重40g,上述两个反应都发生,设由NO2与纯碱反应产生的CO2为amol,由NO和NO2与纯碱反应产生的CO2为bmol,则:a+b=1,48a+32b=40,解得a=b=0.5,所以n(NaNO2):n(NaNO3)=(a+2b):a=1.5:0.5=3:1,故答案为:3:1。


科目:高中化学 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A、KNO3盐桥中的K+移向Cu(NO3)2溶液
B、Cu作负极,发生还原反应
C、电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D、工作一段时间后,AgNO3溶液中c(Ag+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是化工生产的主要原料之一,氨气的用途非常广泛。在一固定容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,发生如下反应: N2(g)+3H2(g)![]() 2NH3(g)△H=-Q kJ/mol(Q>0)。
2NH3(g)△H=-Q kJ/mol(Q>0)。
(1)该反应所用的催化剂是_______(填写名称);该反应450℃时的平衡常数______500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是_______
A. 3v正(H2)=2v逆(NH3) B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2 mol计算从反应开始到平衡时,平均反应速率v(N2)为______________。
(4)在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,则产生的NH3的物质的量比原平衡产生的NH3______(填“多”或“少”或”“一样”)。
(5)工厂生产的氨水稀释后可作肥料。稀释氨水时,随着水的增加溶液中减少的是_______
a.  b.
b. 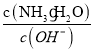 c.
c. 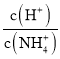 d.
d. 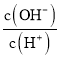
(6)液氨和水类似,也能电离:2NH3![]() NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
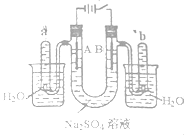
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节考核:
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知该温度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________________。
学法题:通过上题第(2)问的计算,请思考利用溶度积常数(Ksp)进行定量计算,代入离子浓度时需要注意的关键是什么?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
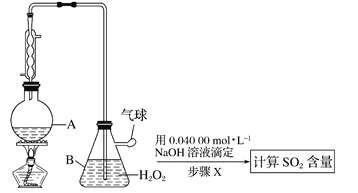
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:

(1)蒽与X都属于________。
a.环烃 b.烃 c.不饱和烃
(2)苯炔的分子式为________,苯炔不具有的性质是________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是________(填字母)。
A. 
B. 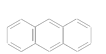
C. 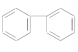
D. ![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而退色,还能使酸性高锰酸钾溶液退色的是___。
A. ![]()
B.C6H14
C. ![]()
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com