
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
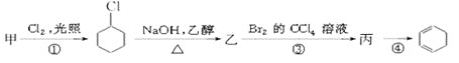
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④混合气体的总物质的量
A. ①② B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节考核:
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知该温度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________________。
学法题:通过上题第(2)问的计算,请思考利用溶度积常数(Ksp)进行定量计算,代入离子浓度时需要注意的关键是什么?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
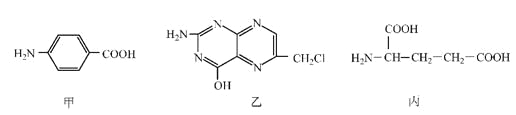
(1)甲中显酸性的官能团是_______________(填名称)。
(2)下列关于乙的说法正确的是__________________(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________________。
a.含有![]() b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
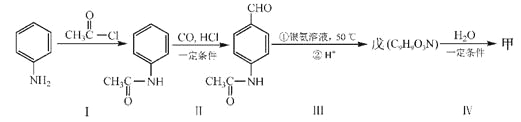
①步骤I的反应类型是______________________。
②步骤I和Ⅳ在合成甲过程中的目的是____________________。
③步骤Ⅳ反应的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
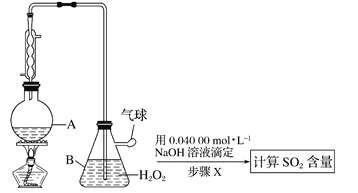
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较纯碱的两种工业制法,正确的是
选项 | 项目 | 氨碱法 | 联合制碱法 |
A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
B. | 可能的副产物 | 氯化钙 | 氯化铵 |
C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com