
【题目】某工厂用含碳、氢、氧三种元素的有机物A和B为原料合成有机化合物H(C11H12O2)的路线示意图如下:

已知: 两个醛分子间能发生如下反应:
 (﹣R、﹣R’表示氢原子或烃基)
(﹣R、﹣R’表示氢原子或烃基)
(1)经质谱法测定,有机物A的相对分子质量为46,经元素分析知A分子中C、H和O原子个数比为2:6:1 。则有机物A的分子式为______________
(2)芳香族化合物B的分子式为C7H8O,C能与钠反应,但不与NaOH反应。则C的结构简式为 ____________________________。
(3)写出A转化为C的化学方程式:__________________________________________________________
(4)检验C中含有的官能团的化学实验方法是_____________________________________________________________________________________________________________________________________
(5)写出E的结构简式:____________________;H的结构简式:________________________________
(6)上述合成过程中没有涉及到的反应类型是:_________________(填写序号)
A.取代反应; b . 加成反应; c. 消去反应; d. 氧化反应; e. 还原反应
【答案】C2H6O  2 CH3CH2OH + O2
2 CH3CH2OH + O2![]() 2 CH3CHO+ 2 H2O 取少量乙醛溶液于试管中,加入适量新制Cu(OH)2,加热,若产生红色沉淀,说明乙醛中含有醛基。(或取少量乙醛溶液于试管中,加入适量银氨溶液,水浴加热,若产生光亮银镜,说明乙醛中含有醛基。)
2 CH3CHO+ 2 H2O 取少量乙醛溶液于试管中,加入适量新制Cu(OH)2,加热,若产生红色沉淀,说明乙醛中含有醛基。(或取少量乙醛溶液于试管中,加入适量银氨溶液,水浴加热,若产生光亮银镜,说明乙醛中含有醛基。) 
 e
e
【解析】
本题以合成反应流程图为背景,考查有机物分子式的计算、结构简式的推断、化学方程式的书写、官能团的检验等。难度较小。
比较“已知”反应的反应物、生成物结构,知其本质为:碱性条件下,一个醛分子的αH与另一个醛分子的醛基发生加成反应,生成β-羟基醛。
(1)因A分子中C、H、O原子个数比为2:6:1,设A分子式(C2H6O)n。又A相对分子质量为46,得46n=46,则n=1。即A分子式C2H6O。
(2)B是芳香化合物,即分子中有苯环。与钠反应、不与NaOH反应,则有醇羟基、不是酚羟基。故B只能是苯甲醇C6H5CH2OH。
(3)A催化氧化生成的C为CH3CHO,化学方程式为2 CH3CH2OH + O2![]() 2 CH3CHO+ 2 H2O。
2 CH3CHO+ 2 H2O。
(4)C中官能团是醛基,检验醛基可用银氨溶液水浴加热生成银镜,或与新制氢氧化铜的碱性浊液共热,生成砖红色沉淀。
(5)由B:C6H5CH2OH可推D:C6H5CHO。据“已知”在C+D→E时,是C的αH与D的醛基加成反应,生成的E为 。则E→F是消去反应,F→G是将醛基氧化为-COOH,G→H为G与乙醇的酯化反应,H结构简式
。则E→F是消去反应,F→G是将醛基氧化为-COOH,G→H为G与乙醇的酯化反应,H结构简式 。
。
(6)综上分析,合成过程中氧化反应有A→C、B→D、F→G;加成反应有C+D→E;消去反应有E→F;取代反应(酯化反应)有G→H,没有涉及还原反应;答案选e。


科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计左下图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如右下图,下列有关叙述错误的是

A. pH>0.68时,甲烧杯中石墨为负极
B. pH=0.68时,反应处于平衡状态
C. pH>0.68时,氧化性I2>AsO43-
D. pH=5时,负极电极反应式为2I--2e-=I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定硫铁矿(主要成分FeS2)矿样中硫元素的质量分数,进行如下实验:将m1g样品放入如图所示装置C中,打开K1关闭K2,从a处不断通入空气,高温灼烧石英管中的样品。

请回答下列问题:
(1)装置B的名称为_____;a处不断通入空气的目的是_____。
(2)装置A的作用是_____。
(3)反应结束后,关闭K1打开K2,向烧瓶中加入液体,点燃G处酒精灯,使烧瓶中反应发生,操作流程如图。

①操作I所得溶液中所含的溶质有_____。
②操作Ⅱ是洗涤、烘干、称重,检验固体是否洗净的方法是_____。
③该硫铁矿中硫元素的质量分数为_____(用含m1、m2的代数式表示)
(4)取煅烧后的熔渣(含有Fe2O3、FeO),欲验证其中存在FeO,应选用的试剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置和方法进行相应实验,能达到实验目的的是
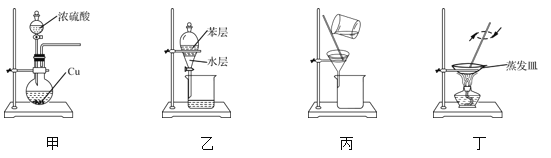
A. 用装置甲制备SO2
B. 用装置乙从碘水溶液中萃取碘
C. 用装置丙除去粗盐溶液中混有的KCl杂质
D. 用装置丁蒸干溶液获得(NH4)2CO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,且原子序数依次增大,X与W同主族,Z与R同主族,X的原子半径比Y的小,Y的最高价氧化物对应的水化物是强酸,Z的最外层电子数是其内层电子数的3倍。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)
B. 简单气态氢化物的热稳定性:Y>Z
C. R的氧化物对应的水化物均为强酸
D. W2Z2与X2R均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是

A. 在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-)
B. 当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4)
C. 当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4)
D. 当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知:2NO2(g)= N2O4(g) △H=-55.3kJ/mol
N2O5(g)=2NO2(g)+![]() O2(g) △H=+53.1 kJ/mol
O2(g) △H=+53.1 kJ/mol
则:N2O5(g)=N2O4(g)+![]() O2(g) △H=___________ kJ/mol
O2(g) △H=___________ kJ/mol
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为___________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是___________。

(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率υ(NO)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________ L/mol。 (结果保留3位有效数字)。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T2___________T1(填“>”、“<”或“=")。
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应)< υ(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com