
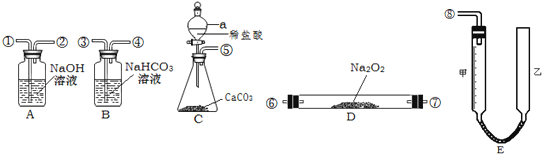
����Ŀ��ij�о���ѧϰС��ģ���������е��йط�Ӧԭ���������ͼ��ʾ����������ȡ���������������������ͼ������װ��E�ɼס���������������ɣ���������Ƥ����ͨ����װ������ˮ�����п̶�(050mL)�������ã��ҹܿ������ƶ�����Һ��ߵ͡�(���ӽ��ܼ��г�װ�þ�ʡ��)
��ش�
��1��ͼ�и�װ�ýӿ�����˳����___________________________(����ӿڵı��)��
��2��װ��A��������______________����Ӧ�Ļ�ѧ����ʽΪ________________��
��3��װ��B��������________________����Ӧ�����ӷ���ʽΪ______________��
��4��װ��C������a��������______��װ��D�з�Ӧ�Ļ�ѧ����ʽΪ________��
��5��ʵ�������ȡ�������ʱ��������Һ����ڼ���Һ�棬��ʹ��õ��������___(��ƫ��ƫС����Ӱ��)������Ӱ�죬Ӧ��__________(����������������)�ƶ��ҹܣ�ʹ����Һ����ƽ(ע������һ������Ӱ�죬�ڶ�������д)��
���𰸡��ݢۢܢޢߢ٢ڢࣨ�ޡ��߿ɻ�λ�� ��ȥ����O2��δ��Ӧ��CO2 2NaOH+CO2��Na2CO3+H2O ����CO2�л��е�HCl HCO3��+H+��H2O+CO2�� ��Һ©�� 2Na2O2+2CO2��2Na2CO3+O2��2Na2O2+2H2O��4NaOH+O2�� ƫС ��
��������
����װ��C��ȡ������̼��������̼��������Һ��ȥ������̼�е��Ȼ����ʹ��������Ʒ�Ӧ����Ӧ����ͨ��NaOH��Һ������δ��Ӧ�Ķ�����̼�����ɵ����������������в������
��1��ʵ����ͼӦ��������ȡCO2��Ȼ����ӣ���ͨ�����������O2��Ȼ���ȥO2�е����ʣ��ٲ���O2����������ԣ�ͼ�и�װ�ýӿ�����˳���Ǣݢۢܢޢߢڢ٢ࣨ�ޡ��߿ɻ�λ����
��2��װ��A�������dz�ȥ����O2��δ��Ӧ��CO2������������Һ�������̼��Ӧ����̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ2NaOH+CO2��Na2CO3+H2O��
��3��װ��B������������CO2�л��е�HCl��̼��������Һ���Ȼ��ⷴӦ�����Ȼ��ơ�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪHCO3��+H+��H2O+CO2����
��4�����������Ĺ����֪��װ��C������a�������Ƿ�Һ©����װ��D��ˮ������������̼������Na2O2��Ӧ����������2Na2O2+2CO2��2Na2CO3+O2��2Na2O2+2H2O��4NaOH+O2����
��5��Ϊ�˽�ȷ������������������˱���������װ�õ�������֮�⣬�ڶ���Ӧǰ�����Һ��Ķ��������ֵ�Ĺ�����Ӧע�⣺�����밼Һ����ʹ���ƽ������ʱӦ�����ƶ��ҹܣ�ʹ��������Һ����ƽ��ʵ�������ȡ�������ʱ��������Һ����ڼ���Һ�棬��ʹ��õ��������ƫС��Ӧ�����ƶ��ҹܣ�ʹ����Һ����ƽ��


 �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ��(�缫��Ϊ���Ե缫)������SO2�����������ų�����Һ����NO2������˵����ȷ����

A. aΪֱ����Դ�ĸ���
B. �����ĵ缫��ӦʽΪ2HSO3-��2H��+e-=S2O42-+2H2O
C. �����ĵ缫��ӦʽΪSO2��2H2O-2e��=SO42-+4H��
D. ���ʱ��H����������ͨ�������ӽ���Ĥ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������ͼ��ʾ��װ���Ʊ���������������������й���������ȷ���ǣ� ��
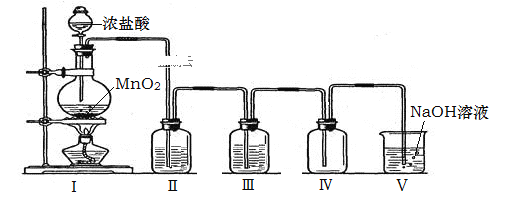
A.��ʵ�����˳��Ϊ������װ�������������ӹ���ҩƷ������Һ��ҩƷ������
B.װ�â��е��Լ�����ΪŨ���ᡢ����NaCl��Һ
C.�����ܶȱȿ�����װ�â��г����ܽ������̵��ܳ���
D.װ�â��з�Ӧ�����ӷ���ʽΪ��Cl2+2OH����Cl��+ClO��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������в�ͬ�ķ����������˵����ȷ���ǣ� ��
�ٴ����Ԫ�ط֣���������������
�ڴӷ�����̼�Ǽ���״�֣���״�л��������״�л�������
�۴ӹ����ŷ֣�ϩ����Ȳ����±�����������ӡ�ȩ��ͪ�����ᡢ����
��![]() �ɻ���Ϊ������״�л����������
�ɻ���Ϊ������״�л����������
A. �٢ۢ�B. �٢ڢ�C. �٢ڢ�D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ͬʱ��ø���Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС������ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�

����Ҫ����գ�
��1������a��������______________________��Bװ�������ֹ��ܣ��ٸ��������壻�ڽ������Ͼ��ȣ���___________________________��
��2��Cװ����CH4��Cl2��Ӧ����һ�ȴ���Ļ�ѧ��Ӧ��ʽ��_______________________��
Dװ���е�ʯ���Ͼ��ȸ��ų�ʪ��KI��д����Ӧ�����ӷ���ʽ��____________________��
��3��Eװ���г��������������⣬�������л����E�з�����������ѷ���Ϊ___________
��4��Eװ�õ�������____________��������ţ���
A���ռ����� B���������� C����ֹ���� D�������Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ������NaOH��Һ�У�Al��2OH����AlO2����H2��
B. ��Pt�缫��ⱥ���Ȼ�þ��Һ��2Cl-+2H2O![]() 2OH-+H2��+Cl2��
2OH-+H2��+Cl2��
C. ��Fe��OH��3��Һ�еμ�HI��Һ��Fe��OH��3+3H+ =Fe3++3H2O
D. ��NaOH��Һ�еμ�ͬŨ�ȵ�����Ca��HCO3��2��Һ��Ca2++2HCO3��+2OH��=CaCO3��+CO32-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪NaNO2�ܷ������·�Ӧ��2NaNO2��4HI=2NO����I2��2NaI��2H2O��
(1)������Ӧ����������________________��
(2)����������Ӧ������NaNO2��NaCl����ѡ�õ������У���ʳ�ס����⻯�ص�����ֽ�������ۡ����ƣ�����Ϊ����ѡ�õ�������_______________(�����)��
(3)ij����Һ�У�����2%��5%��NaNO2��ֱ���ŷŻ������Ⱦ�������Լ���ʹNaNO2ת��Ϊ�����������Ⱦ��N2����______________(��ѡ����ĸ)��
A��NaClB��NH4ClC��HNO3 D��ŨH2SO4
(4)����ƽ���»�ѧ����ʽ��Al��NaNO3��NaOH==NaAlO2��N2����H2O������Ӧ������ת��5mole���������ɱ�״����N2�����Ϊ_______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ������Ȼ������Ҫ��������������Ҫ�ɷ�ΪAl2O3��������Fe2O3��FeO��SiO2���С���ҵ���ۺ�����������IJ��ֹ����������¡�
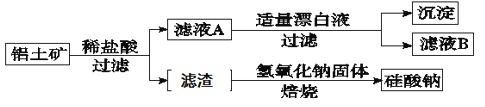
��1������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԡ� �ù������漰ij������ԭ��Ӧ���£�����ɣ���Fe2++��ClO��+ = ��Fe(OH)3��+��Cl��+ ��_________
��2��������ҺB���Ƿ���Fe2+�ķ���Ϊ��__________��
��3������ҺB�е���Ԫ���Գ�����ʽ������ѡ�õ�����Լ�Ϊ______������ţ���
a������������Һ b��������Һ c����ˮ d��������̼
��4������ҺB�Ʊ��Ȼ��������漰�IJ���Ϊ���ߵμ�Ũ���������Ũ����_________����������ƣ������ˡ�ϴ�ӡ�
��5����������Ҫ�ɷ���____________���ѧʽ��������NaOH���屺���Ʊ������ƣ��ɲ��õ�װ��Ϊ____������ţ����÷�Ӧ�Ļ�ѧ����ʽ�� ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������500 mL 0.2 mol��L��1��Na2CO3��Һ��ʵ�����������
������ƽ��ȡһ������Na2CO3��10H2O�������ձ���������������ˮ������ȫ�ܽ⣻
�ڰ��Ƶõ���ҺС�ĵ�ע��______�У�
�ۼ���������ƿ�м�����ˮ��Һ���̶���1 cm��2 cm��������______С�ĵμ�����ˮ����Һ��Һ����ʹ���̶������У�
������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ת��������ƿ��������ҡ�ȣ�
�ݽ�����ƿ�����������ҡ�ȡ�
����д���пհף�
(1)�����������ȷ˳��Ϊ(�����)_________��
(2)д���ڢ۲����У���ȱ������______________��______________��
(3)��ʵ���������������Һ�����ʵ���Ũ���ǣ� ��ƫ�� ��ƫ�� ��ûӰ��
A.��ˮ����ʱ���ӿ̶���________(�����)
B.���ǽ�ϴ��Һת������ƿ__________(�����)
C.ʹ��ǰ����ƿ������ˮϴ�ӣ���û�и���__________ (�����)
D.����ʱ����С�ļ�ˮ�����������ý�ͷ�ι����� __________ (�����)
(4)��������Na2CO3��10H2O������__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com