
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
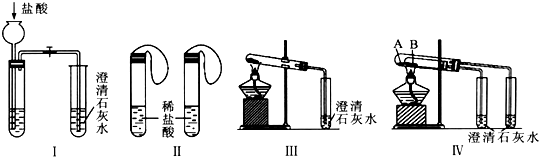
分析 (1)试管A中温度高、试管B中温度低,将碳酸氢钠放在试管低的试管中,如果碳酸氢钠分解了而碳酸钠没有分解,据此可以证明碳酸钠的稳定性大于碳酸氢钠;试管A连接的是右边的小试管,试管B连接的是左边的小试管,澄清石灰水变浑浊,证明对应的物质稳定性小;
(2)根据实验现象是否有明显区别进行判断;根据等质量时产生二氧化碳的量进行分析,因为Na2CO3和NaHCO3与盐酸反应时都能放出CO2,故I不能达到实验目的;等质量的Na2CO3、NaHCO3固体与盐酸反应时,NaHCO3生成的气体多,故Ⅱ可以;加热NaHCO3和Na2CO3固体时,NaHCO3受热分解,Na2CO3不分解,故Ⅲ、Ⅳ也可以达到实验目的;
(3)利用固体样品的质量和沉淀总质量,可以通过实验Ⅲ测量Na2CO3固体中混有的少量NaHCO3的质量分数;
(4)碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠.
解答 解:(1)给碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定;当右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊,说明碳酸钠比碳酸氢钠稳定,
故答案为:NaHCO3;右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊;
(2)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;而Ⅱ利用等质量的碳酸钠、碳酸氢钠产生的二氧化碳的体积不同可以鉴别,Ⅲ可以通过分别加热碳酸钠、碳酸钠,根据澄清石灰水是否变浑浊鉴别、Ⅳ根据澄清石灰水是否变浑浊鉴别二者,所以能够达到实验目的是Ⅱ、Ⅲ、Ⅳ;
实验Ⅱ中,鉴别原理为:等质量的碳酸钠、碳酸氢钠中,根据关系式Na2CO3~CO2、NaHCO3~CO2可知,碳酸氢钠产生的二氧化碳多,泡沫灭火器用碳酸氢钠的原因是:等质量时碳酸氢钠产生的二氧化碳多,
故答案为:Ⅱ、Ⅲ、Ⅳ;Ⅱ;
(3)采用实验Ⅲ,加热后利用固体样品的质量和沉淀总质量,可以测定Na2CO3固体中混有的少量NaHCO3的质量分数,
故答案为:能;固体样品的质量和沉淀总质量(或反应前后固体的质量);
(4)碳酸钠能和氯化钙反应CaCl2+Na2CO3═CaCO3↓+2NaCl,离子反应为:Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓.
点评 本题考查了碳酸钠、碳酸氢钠的性质、实验方案的设计与评价,题目难度中等,注意掌握碳酸钠、碳酸氢钠的性质,能够正确书写反应的化学方程式,明确实验方案的设计与评价的方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛有蒸馏水的洗气瓶 | |
| D. | 混合气体通过盛有NaOH溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{2.4R}$ mol•L-1 | B. | $\frac{1000nρ}{17n+22.4m}$mol•L-1 | ||
| C. | $\frac{n}{22.4}$mol•L-1 | D. | $\frac{1000ρ}{17n+22.4m}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高级脂肪酸甘油酯是高分子化合物 | |
| B. | 天然的不饱和高级脂肪酸甘油酯都是混甘油酯 | |
| C. | 植物油可以使酸性高锰酸钾溶液褪色 | |
| D. | 油脂皂化完全后原有的液体分层现象消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 聚丙烯塑料的结构简式为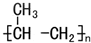 | |
| B. | 聚氯乙烯塑料单体的电子式为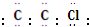 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子半径 | 熔点 | 酸性 |
| Cl- >Na+ | NaCl <C(金刚石) | H3PO4 <HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com