
| A. | 高级脂肪酸甘油酯是高分子化合物 | |
| B. | 天然的不饱和高级脂肪酸甘油酯都是混甘油酯 | |
| C. | 植物油可以使酸性高锰酸钾溶液褪色 | |
| D. | 油脂皂化完全后原有的液体分层现象消失 |
分析 A.高分子化合物的相对分子质量一般为几万到几千万;
B.天然的不饱和高级脂肪酸甘油酯一般为混甘油酯;
C.植物油的主要成分是不饱和高级脂肪酸甘油酯,含有碳碳双键;
D.皂化反应基本完成时生成高级脂肪酸盐和甘油均易溶于水,因此反应后静置,反应液不分层.
解答 解:A.高分子化合物一般相对分子质量过万,而高级脂肪酸甘油酯不是高分子化合物,故A错误;
B.天然的不饱和高级脂肪酸甘油酯都是由不同的不饱和高级脂肪酸和甘油形成的混甘油酯,故B正确;
C.植物油的主要成分是不饱和高级脂肪酸甘油酯,含有碳碳双键,能被酸性高锰酸钾溶液氧化,而使酸性高锰酸钾溶液褪色,故C正确;
D.皂化反应基本完成时高级脂肪酸甘油酯在碱性条件下水解生成高级脂肪酸盐和甘油均易溶于水,因此反应后静置,反应液不分层,故D正确;
故选A.
点评 本题考查油脂的结构与性质,难度不大,重点掌握油脂的皂化反应的实验原理、步骤、现象.


科目:高中化学 来源: 题型:解答题
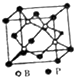 硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用.
硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解产物在应用中都只能作为氧化剂 | |
| B. | 电解一段时间后,溶液pH不变 | |
| C. | 阳极反应:3H2O-6e-═O3+6H+ | |
| D. | 每生成1 mol O3转移电子数为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
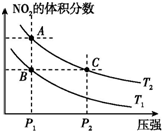
| A. | 两种不同的温度比较:T1>T2 | |
| B. | A、C两点的反应速率:A>C | |
| C. | B、C两点的气体的平均相对分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热的方法实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
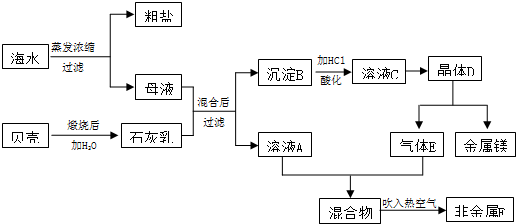
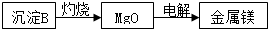
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com