
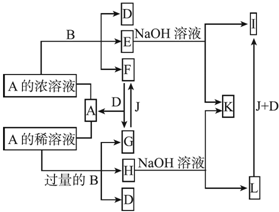
分析 E、H与氢氧化钠溶液反应分别生成I、L,I和L又能和J、D发生转化,说明金属B为变价金属,B可能为Fe.E、H均为B盐溶液,A能与B反应生成多种物质,说明A为酸,A与Fe反应时与酸的浓度有关,则A可能是硫酸或硝酸,根据G+J→F可以判断A是硝酸不是硫酸(氢气与二氧化硫无法转化),故酸A为HNO3,B为Fe,结合转化关系,可推知F为NO2,A为HNO3,E为Fe(NO3)3、D为H2O、I为Fe(OH)3、G为NO、F为O2、H为Fe(NO3)2,L为Fe(OH)2,K为NaNO3,据此解答.
解答 解:E、H与氢氧化钠溶液反应分别生成I、L,I和L又能和J、D发生转化,说明金属B为变价金属,B可能为Fe.E、H均为B盐溶液,A能与B反应生成多种物质,说明A为酸,A与Fe反应时与酸的浓度有关,则A可能是硫酸或硝酸,根据G+J→F可以判断A是硝酸不是硫酸(氢气与二氧化硫无法转化),故酸A为HNO3,B为Fe,结合转化关系,可推知F为NO2,A为HNO3,E为Fe(NO3)3、D为H2O、I为Fe(OH)3、G为NO、F为O2、H为Fe(NO3)2,L为Fe(OH)2,K为NaNO3.
(1)金属B为Fe,在元素周期表中的位置是:第四周期Ⅷ族,Fe和浓硝酸反应的条件是:加热,少量Fe与稀硝酸反应的离子方程式:Fe+4H++NO3-=Fe2++NO↑+2H2O,
故答案为:第四周期Ⅷ族;加热;Fe+4H++NO3-=Fe2++NO↑+2H2O;
(2)常温下0.1 mol/L Fe(NO3)3的水溶液中Fe3+水解,溶液呈酸性,各离子浓度大小关系为:,
故答案为:c(NO3-)>c(Fe3+)>c(OH-)>c(H+),
故答案为:c(NO3-)>c(Fe3+)>c(OH-)>c(H+);
(3)L转化成I的现象是:白色沉淀变成灰绿色,最终变成红褐色,有关的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)检测Fe(NO3)2溶液中阳离子的存在:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+,
故答案为:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+;
(5)等体积混合的瞬间,体积加倍浓度减半,混合后溶液中的c(Fe3+)=2×10-8mol/L,c(OH-)=1×10-8mol/L,则Qc=c(Fe3+)×c3(OH-)=2.0×10-32>Ksp,有沉淀生成,
故答案为:混合后溶液中的c(Fe3+)=2×10-8mol/L,c(OH-)=1×10-8mol/L,则Qc=c(Fe3+)×c3(OH-)=2.0×10-32>Ksp,有沉淀生成.
点评 本题考查无机物推断,涉及Fe、N元素化合物性质与转化,需要学生熟练掌握元素化合物性质,侧重考查学生分析推理能力,难度较大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | |
| B. | 分别加稀硫酸煮沸,再加足量NaOH溶液调至碱性,加银氨溶液加热观察有无银镜 | |
| C. | 分别加热水溶解,观察溶解性 | |
| D. | 放在嘴里咀嚼,有无甜味产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A浓度表示该反应速率为1.6 mol/(L•min) | |
| B. | 若使容器体积变为1 L,则B的物质的量一定减小 | |
| C. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| D. | 若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高级脂肪酸甘油酯是高分子化合物 | |
| B. | 天然的不饱和高级脂肪酸甘油酯都是混甘油酯 | |
| C. | 植物油可以使酸性高锰酸钾溶液褪色 | |
| D. | 油脂皂化完全后原有的液体分层现象消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
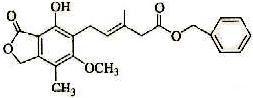
| A. | 一定条件下,既可以与Br2发生加成反应,又可以与Br2发生取代反应 | |
| B. | 1 mol该化合物最多可以与3 molNaOH反应 | |
| C. | 既可以催化加氢,又可以在稀硫酸存在下水解得2种有机物 | |
| D. | 可以与Na2CO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com