
| A. | 利用铝热反应大规模冶炼钢铁 | |
| B. | 用一氧化碳高温还原氧化铝提纯铝 | |
| C. | 西汉时期我国就采用“湿法冶铜”术 | |
| D. | 利用高温分解硫酸钙得到的二氧化硫制备硫酸 |
科目:高中化学 来源: 题型:选择题
| A. | AgCl沉淀生成和沉淀溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | AgCl在相同浓度的CaCl2和NaCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
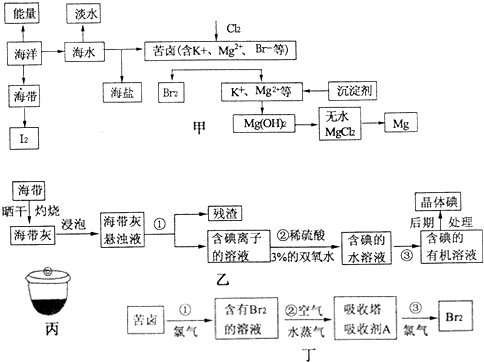
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定是ⅡA元素 | |
| B. | 第三周期元素对应的离子半径从左往右依次减小 | |
| C. | 第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱 | |
| D. | 第三周期的主族元素的最高正价一定等于其最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸 | B. | 氯化钠晶体 | C. | 浓氨水 | D. | 氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 | |
| B. | 任何离子键在形成的过程中必定有电子的得与失 | |
| C. | 在氯化钠中,氯离子和钠离子靠静电作用结合 | |
| D. | 金属钠与氯气反应生成氯化钠后,体系能量降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com