
【题目】实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀,图中圆的大小代表分散质粒子的相对大小。下列说法正确的是

A. 分散系Ⅰ为溶液
B. 制备分散系I的离子方程式为Ag++Cl-=AgCl(胶体)
C. 分散系Ⅱ为胶体
D. 两分散系的本质区别是是否有丁达尔现象
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。

(1)图1中,电解一段时间后,气球b中的气体是__________(填化学式),U形管________(填“左”或“右”)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的________极;该发生器中反应的总离子方程式为_______________________________。
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。下图是目前已开发出用电解法制取ClO2的新工艺。

①阳极产生ClO2的电极反应式:__________________________________________________。
②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜的离子物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____________。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率________;该温度下的平衡常数为______;若保持容器温度不变,下列措施可增加甲醇产率的________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米微晶碱式碳酸锌是一种新型的碱式碳酸锌,在医药行业可用作皮肤保护剂,在化妆品生产中用作基础原料。用工业级硫酸锌(主要成分ZnSO4·7H2O,含少量Fe2+、Cu2+、Cd2+、Co2+、Ni2+)制备纳米微晶碱式碳酸锌[ Zn4CO3(OH)6]的一种流程如下:
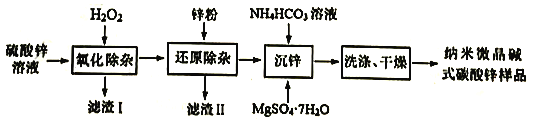
回答下列问题:
(1)配制硫酸锌溶液:①烧杯中加入100g工业级硫酸锌;②加入116mL的蒸馏水,用玻璃棒搅拌,直至完全溶解,得160mL溶液。配制时还需用到的玻璃仪器是___________,所得ZnSO4溶液的物质的量浓度约为___________。(已知ZnSO·7H2O的摩尔质量为287g·mol-1)
(2)“氧化除杂”是除去溶液中Fe2+
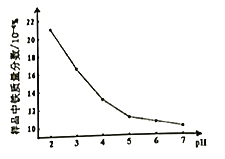
①滤渣I的主要成分是___________(填化学式)。
②控制其它条件不变,溶液的pH对H2O2除铁效果的影响如图,除铁时应控制溶液pH为___________(填整数值)。(已知:ksp[Zn(OH)2]=1.2×10-17,溶液体积变化忽略不计)
(3)“还原除杂”。除Cu2+、Cd2+后,再加入Zn粉和少量Sb2S3,形成锑锌微电池,提高除Co2+、Ni2+的反应速率。则Zn2+、Co2+、Sb3+的氧化性强弱顺序:___________>___________>___________(填离子符号)。_______________
(4)“沉锌时,①生成纳米微晶碱式碳酸锌的离子方程式为______________________。
②加入MgSO4·7H2O的目的主要是降低所得粉体的晶粒度,但也要保证主元素的质量分数在56%以上。下表是不同Mg:Zn(质量比)对产品品粒度及Zn质量分数的影响:
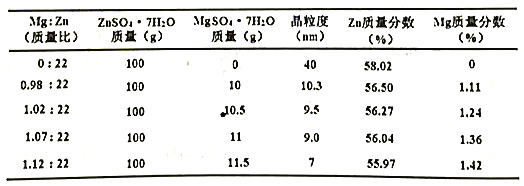
Mg︰Zn(质量比)不宜超过______________________。
(5)用EDTA滴定法测样品中锌的含量,反应式为Zn2++H2Y2-=ZnY2-+2H+。取a g纳米微晶碱式碳酸锌样品,在pH为5~6的乙酸-乙酸钠缓冲溶液中,以二甲酚橙作指示剂,用 b mol· L-1EDTA(H2Y2-)标准溶液滴定,消耗EDTA溶液c mL则样品中锌的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法错误的是( )
A.丙烷属于饱和链烃
B.甲烷分子是正四面体结构
C.甲烷分子中四个C-H键是完全等价的键
D.丁烷分子中含有除共价键以外的化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com