
| A. | NaOH | B. | HCl | C. | NaCl | D. | K2SO3 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质的制备与工业生产相符的是
①NH3  NO
NO 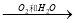 HNO3
HNO3
②浓HCl 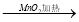 Cl2
Cl2  漂白粉
漂白粉
③MgCl2(aq) 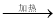 无水MgCl2
无水MgCl2  Mg
Mg
④饱和NaCl(aq) 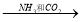 NaHCO3
NaHCO3 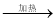 Na2CO3
Na2CO3
⑤铝土矿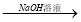 NaAlO2溶液
NaAlO2溶液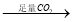 Al(OH)3
Al(OH)3 Al2O3
Al2O3  Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
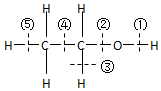
| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向沸腾的蒸馏水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C | 检验溶液中是否含有SO42- | 取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化 | |
| C. | 生石灰制熟石灰 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com