
【题目】已知:CaCO3(s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
A.低温 B.高温
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于催化剂的说法不正确的是( )
A. 温度越高,催化剂的催化效果越好
B. 汽车排气管上的“催化转化器”能减少有害气体排放
C. 催化剂可以改变化学反应速率,但反应前后质量和化学性质不变
D. 锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等。
(1)下列ΔH表示物质标准燃烧热的是___________;表示中和反应反应热的是___________。(填“ΔH1”、“ΔH2”、“ΔH3”等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+![]() O2(g)===CO(g) ΔH2=-Q1kJ·mol-1
O2(g)===CO(g) ΔH2=-Q1kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4=-Q2kJ·mol-1
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:_________________。
(3)根据题(1)中B、D判断1 molCO(g)完全燃烧的ΔH= 。
(4)反应E的ΔH6可以用如图所示的装置进行测量。实验中直接测定的数据是 ;

从实验装置上看,图中尚缺少的一种玻璃用品是_____________;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值___________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铁粉制备摩尔盐的操作流程如下:

(1)流程中“趁热”过滤的原因是__________。
(2)检验反应1溶液中是否含Fe3+的实验方法为___________。
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704g新制摩尔盐,溶于水配制成100.0mL溶液,再将该溶液分成两等份。向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796g。另一份溶液用0.0500mol·L-1K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00mL。
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5mol·L-1),则此时c[(Ba(OH)2]≥________mol·L-1。
②确定该摩尔盐的化学式(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。
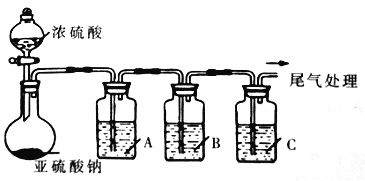
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。
①请完成下列表格
试剂 | 作用 | |
A | _______ | 验证SO2的还原性 |
B | Na2S溶液 | ___ |
C | 品红溶液 | ___ |
②A中发生反应的离子方程式为_______________________。
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为____________。
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00ml葡萄酒样品于250ml碘量瓶中。加入少量碎冰块,再加入1ml淀粉指示液,10ml硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为Vml。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml。该葡萄酒中SO2含量计算式为___g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com