
 ②
② ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
 NH4++OH-,加水稀释弱电解的电离平衡向正向进行,故①②正确。(3)有上知,A为盐酸,B为醋酸,OH-浓度相同的等体积的两份溶液A和E,说明A和E的pH相同,故二者c(H+)相同,故开始时的反应速率相同,随反应的进行c(H+)减小,而醋酸中c(H+)减小的慢。PH相同的醋酸和盐酸,醋酸的物质的量多,故盐酸完全反应,A中锌粉有剩余;由于产生的氢气一样多,故参加反应的锌粉相同。(4)等体积、等物质的量浓度B和C混合后的溶液为NH4SO4其水解显酸性,升温水解平衡正向移动,c(H+)增大,pH减小,故选④;(5)
NH4++OH-,加水稀释弱电解的电离平衡向正向进行,故①②正确。(3)有上知,A为盐酸,B为醋酸,OH-浓度相同的等体积的两份溶液A和E,说明A和E的pH相同,故二者c(H+)相同,故开始时的反应速率相同,随反应的进行c(H+)减小,而醋酸中c(H+)减小的慢。PH相同的醋酸和盐酸,醋酸的物质的量多,故盐酸完全反应,A中锌粉有剩余;由于产生的氢气一样多,故参加反应的锌粉相同。(4)等体积、等物质的量浓度B和C混合后的溶液为NH4SO4其水解显酸性,升温水解平衡正向移动,c(H+)增大,pH减小,故选④;(5)

科目:高中化学 来源:不详 题型:单选题
A.氨水使酚酞溶液变红:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| B.向FeCl3溶液中加入Mg(OH)2,溶液中有红褐色沉淀生成:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| C.铅蓄电池放电时的正极反应为:PbO2+2e–+4H+=Pb2++2H2O |
| D.钢铁的析氢腐蚀与吸氧腐蚀的负极电极反应相同:Fe-3e–=Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑥⑦ | B.③④⑤⑥ | C.③④⑥⑦ | D.①② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.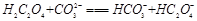 |
B.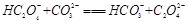 |
C.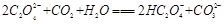 |
D.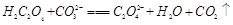 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com