
ЁОЬтФПЁПаПИЁдќжївЊКЌZnЁЂZnOЁЂSiO2ЁЂFe2+ЁЂCd2+ЁЂMn2+ЃЌЙЄвЕЩЯПЩЭЈЙ§ПижЦЬѕМўж№вЛГ§ШЅдгжЪвджЦБИГЌЯИЛюадбѕЛЏаПЃЌЦфЙЄвеСїГЬШчЯТЃК
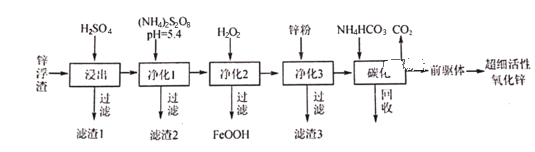
(1)ТЫдќ1ЕФГЩЗжЮЊ___________ЁЃ
(2)дкS2O82ЃЕФНсЙЙЪНжажЛКЌгавЛИљЁАOвЛOЁБЗЧМЋадМќЃЌдђSЕФЛЏКЯМлЮЊ___________ЃЛЙЄвЕЩЯГЃгУЖшадЕчМЋЕчНт(NH4)2SO4ЩњВњ(NH4)2S2O8(Й§ЖўСђЫсяЇ)ЃЌбєМЋЕчМЋЗДгІЪНЮЊ__________________ЁЃОЛЛЏ1ЪЧЮЊСЫНЋMn2+зЊЛЏЮЊMnO2ЖјГ§ШЅЃЌаДГіИУЗДгІЕФРызгЗНГЬЪНЃК______________________ЁЃ
(3)ОЛЛЏ3ЕФФПЕФ_________________________________ЁЃ
(4)ЬМЛЏЛиЪеШмвКЕФжївЊГЩЗжЮЊ___________ЃЌИУЮяжЪбЛЗЪЙгУЕФФПЕФ___________________ЁЃ
(5)ЬМЛЏдк50ЁцНјааЃЌЁАЧАЧ§ЬхЁБЕФЛЏбЇЪНЮЊZnCO3ЁЄ2Zn(OH)2ЁЄH2OЃЌаДГіЬМЛЏЙ§ГЬЩњГЩЁАЧАЧ§ЬхЁБЕФЛЏбЇЗНГЬЪНЃК__________________________________________________ЁЃ
ЁОД№АИЁПЖўбѕЛЏЙш(ЛђSiO2) +6 2SO42- -2e-=S2O82- Mn2ЃЋ+S2O82-+2H2O=MnO2Ё§+2SO42- +4HЃЋ Г§ШЅШмвКжаЕФCd2+ (NH4)2SO4 ПЩгУгкжЦБИ(NH4)2S2O8(Й§ЖўСђЫсяЇ) 3ZnSO4+6NH4HCO3=ZnCO3ЁЄ2Zn(OH)2ЁЄH2OЁ§+3(NH4)2SO4+5CO2Ёќ
ЁОНтЮіЁП
СђЫсгыаПИЁдќжаЫсадбѕЛЏЮяВЛФмЗДгІЃЌЖјгыН№ЪєбѕЛЏЮяМАБШНЯЛюЦУЕФН№ЪєЗДгІЃЌSiO2ВЛФмЗДгІЃЌвдТЫдќ1аЮЪНДцдкЃЛЯђКЌаПЗЯЫЎЃЈжївЊКЌ Zn2+ЁЂFe2+ЁЂCd2+ЁЂMn2+ЃЉМгШы(NH4)2S2O8НЋ Mn2+зЊЛЏЮЊMnO2Г§ШЅЃЌТЫдќ2ЮЊЖўбѕЛЏУЬЃЛЯђОЛЛЏ2ШмвКжаМгШыH2O2ЃЌПЩвдНЋ+2МлЕФFeбѕЛЏЮЊ+3МлЕФFeЃЌаЮГЩFeOOHГСЕэЃЛдкЯђОЛЛЏ3ЕФШмвКжаМгШыаПЛЙдCd2+ЩњГЩЕЅжЪИѕЃЌЙ§ТЫЕУЕНТЫдќ3ЮЊИѕЃЌШЛКѓЯђТЫвКжаМгШыЬМЫсЧтяЇЬМЛЏдк 50ЁцНјааЕУЕН[ZnCO32ZnЃЈOHЃЉ2H2O]ЃЌЬМЛЏЪБЫљгУ NH4HCO3 ЕФЪЕМЪгУСПЮЊРэТлгУСПЕФ 1.1 БЖЃЌетбљПЩвдЪЙ Zn2+ГфЗжГСЕэЃЌЧвНЯИпЮТЖШЯТЬМЫсЧтяЇЗжНтЛсЫ№ЪЇЃЌОнДЫЗжЮіЁЃ
(1)аПИЁдќжївЊКЌZnЁЂZnOЁЂSiO2ЕШЮяжЪЃЌМгШыЯЁСђЫсЃЌZnЁЂZnOгыСђЫсЗДгІБфЮЊZn2+НјШыШмвКЃЌЖјSiO2ЪЧЫсадбѕЛЏЮяЃЌВЛФмгыСђЫсЗДгІЃЌЫљвдТЫдќ1жївЊГЩЗжЪЧЖўбѕЛЏЙшЃЛ
(2)дкS2O82-ЕФНсЙЙЪНжажЛКЌгавЛИљЁАOвЛOЁБЗЧМЋадМќ,дђSгыSдзгжЎМфДцдквЛИіЁЊOЁЊOЁЊЃЌSдзггыЫФИіOдзгаЮГЩЙВМлМќЃЌУПИіSдзгаЮГЩСНИіS=OЫЋМќЃЌСНИіS-OЕЅМќЁЃгЩгкЮќв§ЕчзгЕФФмСІO>SЃЌЫљвдSдЊЫиЕФЛЏКЯМлЮЊ+6МлЃЛгУЖшадЕчМЋЕчНт(NH4)2SO4ЩњВњ(NH4)2S2O8(Й§ЖўСђЫсяЇ)ЃЌSO42-дкбєМЋЩЯЪЇШЅЕчзгЃЌБфЮЊS2O82-ЃЌбєМЋЕчМЋЗДгІЪНЮЊЃК2SO42- -2e-=S2O82-ЃЛОЛЛЏ1ЕФШмвКжаКЌгаZn2+ЁЂMn2+ЁЂFe2+ЁЂCd2+ЃЌЯђОЛЛЏ1ШмвКжаМгШы(NH4)2S2O8ШмвКЃЌ(NH4)2S2O8НЋMn2+бѕЛЏзЊЛЏЮЊMnO2аЮГЩТЫдќ2ЖјЙ§ТЫГ§ШЅЃЌS2O82-дђЛёЕУЕчзгБфЮЊSO42-НјШыШмвКЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊMn2ЃЋ+S2O82-+2H2O=MnO2Ё§+2SO42- +4HЃЋЃЛ
(3)ОЛЛЏ2ЕФФПЕФЪЧМгШыH2O2НЋШмвКжаЕФFe2+бѕЛЏЮЊ+3МлЕФЬњЃЌгыШмвКжаЕФOH-НсКЯаЮГЩFeOOHГСЕэГ§ШЅЃЌЯђОЛЛЏ3ШмвКжаМгШыZnЗлЃЌZn+Cd2+=Zn2++CdЃЌШЛКѓЙ§ТЫЃЌПЩвдНЋЙ§СПЕФZnМАжУЛЛГіЕФCdЕЅжЪЙ§ТЫГ§ШЅЃЌЫљвдТЫдќ3ГЩЗжЮЊZnЁЂCdЃЛ
(4)ОЛЛЏ3вдКѓЕФТЫвКжаКЌгаZn2+ЃЌЯђИУШмвКжаМгШыЬМЫсЧтяЇЬМЛЏЃЌЕУЕНСђЫсяЇКЭЖўбѕЛЏЬММАЁАЧАЧћЬхЁБЃЌЦфЛЏбЇЪНЮЊZnCO32Zn(OH)2H2OЃЌЗДгІЗНГЬЪНЪЧ3ZnSO4+6NH4HCO3=ZnCO32Zn(OH)2H2OЁ§+3(NH4)2SO4+5CO2ЁќЃЌаЮГЩГСЕэКѓЙ§ТЫЃЌЕУЕНЕФТЫвКжажївЊШмжЪЪЧ(NH4)2SO4ЃЌИУЮяжЪКЌгаNдЊЫиЃЌПЩжБНггУзїЕЊЗЪЃЌвВПЩвдгУгкбЛЗЪЙгУжЦБИ(NH4)2S2O8(Й§ЖўСђЫсяЇ)ЁЃ


 жаПМНтЖСПМЕуОЋСЗЯЕСаД№АИ
жаПМНтЖСПМЕуОЋСЗЯЕСаД№АИ ИїЕиЦкФЉИДЯАЬибЕОэЯЕСаД№АИ
ИїЕиЦкФЉИДЯАЬибЕОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(Ђё)бЁдёЯТСаЪЕбщЗНЗЈЗжРыЮяжЪЃЌНЋЗжРыЗНЗЈЕФађКХЬюдкКсЯпЩЯЁЃ
AЁЂнЭШЁЗжвК BЁЂЩ§ЛЊ CЁЂНЕЮТНсОЇ DЁЂЗжвК EЁЂеєСѓ FЁЂЙ§ТЫ
Ђй____ЗжРыБЅКЭЪГбЮЫЎгыЩГзгЕФЛьКЯЮяЃЛ
Ђк____ДгЯѕЫсМиКЭТШЛЏФЦЕФЛьКЯвКжаЛёЕУЯѕЫсМиЃЛ
Ђл____ЗжРыЫЎКЭЦћгЭЕФЛьКЯЮяЃЛ
Ђм____ЗжРыCCl4(ЗаЕуЮЊ76.75Ёц)КЭМзБН(ЗаЕуЮЊ110.6Ёц)ЃЛ
Ђн____ЗжРыГіЛьдкЩГЭСжаЕФЕтЕЅжЪЁЃ
(Ђђ)еЦЮевЧЦїУћГЦЁЂзщзАМАЪЙгУЗНЗЈЪЧжабЇЛЏбЇЪЕбщЕФЛљДЁЁЃШчЭМЮЊЪЕбщЪвжЦШЁеєСѓЫЎЕФЪЕбщзАжУЁЃ

ЃЈ1ЃЉаДГіЯТСавЧЦїЕФУћГЦЃКa.___ЃЛb___
ЃЈ2ЃЉШєРћгУИУзАжУЗжРыЫФТШЛЏЬМКЭОЦОЋЕФЛьКЯЮяЃЌЛЙШБЩйЕФвЧЦїЪЧ____ЃЌНЋвЧЦїВЙГфЭъећКѓНјааЪЕбщЃЌЮТЖШМЦЫЎвјЧђЕФЮЛжУдк___ДІЁЃРфФ§ЫЎгЩ___ЃЈЬюfЛђgЃЉПкЭЈШы___ЃЈЬюfЛђgЃЉСїГіЁЃ
ЃЈ3ЃЉЪЕбщЪБaжаГ§МгШыЩйСПздРДЫЎЭтЃЌЛЙашМгШыЩйСП___ЃЌЦфзїгУЪЧ_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛУмБеШнЦїжаНјааЗДгІ2SO2 + O2![]() 2SO3ЃЌвбжЊЗДгІЙ§ГЬжаФГвЛЪБПЬSO2ЁЂ O2ЁЂSO3ЕФХЈЖШЗжБ№ЮЊ2 molЁЄL-1 ЁЂ1molЁЄL-1 ЁЂ2molЁЄL-1ЁЃЕБЗДгІДяЕНЦНКтЪБЃЌШнЦїФкИїЮяжЪЕФХЈЖШПЩФмЮЊ
2SO3ЃЌвбжЊЗДгІЙ§ГЬжаФГвЛЪБПЬSO2ЁЂ O2ЁЂSO3ЕФХЈЖШЗжБ№ЮЊ2 molЁЄL-1 ЁЂ1molЁЄL-1 ЁЂ2molЁЄL-1ЁЃЕБЗДгІДяЕНЦНКтЪБЃЌШнЦїФкИїЮяжЪЕФХЈЖШПЩФмЮЊ
A. SO2ЮЊ4 molЁЄL-1ЁЂ O2ЮЊ2 molЁЄL-1 B. SO3ЮЊ4 molЁЄL-1
C. SO2ЮЊ2.5 molЁЄL-1 D. SO2 ЁЂSO3ЮЊ1.5 molЁЄL-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЖўдЊШѕМюB(OH)2дкЫЎжаДцдкШчЯТЕчРыЦНКтЃКB(OH)2 ![]() B(OH)++OH-ЃЌKb1=10-3.75ЃЛB(OH)+
B(OH)++OH-ЃЌKb1=10-3.75ЃЛB(OH)+![]() B2++OH-ЃЌKb2=10-7.62ЁЃГЃЮТЯТЃЌгУ0.1 mol/LбЮЫсЕЮЖЈ25 mL 0.1 mol/LЕФB(OH)2ШмвКЃЌЕУЕНШчЭМЫљЪОЕФЕЮЖЈЧњЯпЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
B2++OH-ЃЌKb2=10-7.62ЁЃГЃЮТЯТЃЌгУ0.1 mol/LбЮЫсЕЮЖЈ25 mL 0.1 mol/LЕФB(OH)2ШмвКЃЌЕУЕНШчЭМЫљЪОЕФЕЮЖЈЧњЯпЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. aЕуЫљЕУЕФШмвКжаЃКc[B(OH)2]= c[B(OH)+]
B. bЕуЫљЕУЕФШмвКжаЃКc[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. cЕуЫљЕУЕФШмвКжаЃКc(Cl-)ЃМ3c[B(OH)+]
D. dЕуЫљЕУЕФШмвКжаЃКc(B2+)ЃОc[B(OH)+]ЃОc[B(OH)2]
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЛЏбЇЗДгІЫйТЪЕФЫЕЗЈжаЃЌе§ШЗЕФЪЧ
A. 100 mL 1 mol/LЕФЯЁСђЫсгыаПЗДгІЪБЃЌМгШыЪЪСПЕФТШЛЏФЦШмвКЃЌЩњГЩЧтЦјЕФЫйТЪВЛБф
B. КЯГЩАБЕФЗДгІЪЧвЛИіЗХШШЗДгІЃЌЫљвдЩ§ИпЮТЖШЃЌЗДгІЫйТЪМѕТ§
C. гУЬњЦЌКЭЯЁСђЫсЗДгІжЦШЁЧтЦјЪБЃЌИФгУЬњЦЌКЭХЈСђЫсПЩвдМгПьВњЩњЧтЦјЕФЫйТЪ
D. ЦћГЕЮВЦјжаЕФCOКЭNOПЩвдЛКТ§ЗДгІЩњГЩN2КЭCO2ЃЌМѕаЁбЙЧПЃЌЗДгІЫйТЪМѕТ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПЦбЇМвдкЬьШЛЦјЭбСђбаОПЗНУцШЁЕУСЫаТНјеЙЃЌРћгУШчЭМзАжУНјааЭбСђЃЌНЋСђЛЏЧтЦјЬхзЊЛЏГЩСђГСЕэЁЃвбжЊМзЁЂввГижаЗЂЩњЕФЗДгІЮЊ(гвЭМ)ЃКЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A. ИУзАжУжаЕчФмзЊЛЏЮЊЙтФм
B. ЕчТЗжаУПзЊвЦ0.2molЕчзгЃЌМзГиШмвКжЪСПБфЛЏ 3.4gЃЌввГиШмвКжЪСПБЃГжВЛБф
C. ЙтееЪБввГиЕчМЋЩЯЗЂЩњЕФЗДгІЮЊЃКH2S+I3-=3I-+S+2H+
D. МзГижаЬМАєЩЯЗЂЩњЕФЕчМЋЗДгІЮЊЃКAQ+2H+-2e-=H2AQ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПЦбЇМвбаЗЂСЫвЛжжЪвЮТЯТЁАПЩКєЮќЁБЕФNaЁЊCO2ЖўДЮЕчГиЁЃНЋNaClO4ШмгкгаЛњШмМСзїЮЊЕчНтвКЃЌФЦКЭИКдиЬМФЩУзЙмЕФФјЭјЗжБ№зїЮЊЕчМЋВФСЯЃЌЕчГиЕФзмЗДгІЮЊЃК3CO2+4Na![]() 2Na2CO3+CЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
2Na2CO3+CЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. ЗХЕчЪБЃЌClO4ЃЯђИКМЋвЦЖЏ
B. ГфЕчЪБЪЭЗХCO2ЃЌЗХЕчЪБЮќЪеCO2
C. ЗХЕчЪБЃЌе§МЋЗДгІЮЊЃК3CO2+4e ЃН2CO32Ѓ+C
D. ГфЕчЪБЃЌе§МЋЗДгІЮЊЃКNa++eЃНNa
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯРћгУЕчНтБЅКЭКЭЪГбЮЫЎПЩжЦЕУживЊЛЏЙЄВњЦЗЁЃ
ЃЈ1ЃЉЕчНтБЅКЭЪГбЮЫЎЕФЛЏбЇЗНГЬЪНЮЊЃК ___________________________ЁЃ
ЃЈ2ЃЉЕчНтБЅКЭЪГбЮЫЎЪБЃЌ________МЋЧјИННќШмвКpHБфДѓЁЃ
ЃЈ3ЃЉКЭЕчдДе§МЋЯрСЌЕФЕчМЋЮЊ________МЋЃЌЕУЕНЕФЦјЬхВњЦЗЪЧ________ЃЌМьбщЗНЗЈМАЯжЯѓЮЊ_______________ЃЌМьбщЩцМАЕФЗДгІЗНГЬЪНЪЧ__________________________ЁЃ
ЃЈ4ЃЉЕчНтвЛЖЮЪБМфКѓЃЌШЁвѕМЋЧјШмвКзїЪЕбщЃЌЯТСаНсТлжаДэЮѓЕФЪЧ________ЃЈЬюзжФИЃЉ
A.ЕЮМгзЯЩЋЪЏШяЪдвКЃЌШмвКГЪКьЩЋ
B.ЕЮМгТШЛЏУОШмвКЃЌгаАзЩЋГСЕэВњЩњ
C.МгШыЪЏЛвЪЏЃЌгаЦјХнВњЩњ
D.ЯШМгзуСПЯѕЫсЃЌдйЕЮМгЯѕЫсвјШмвКЃЌШєВњЩњГСЕэЫЕУїШмвКжаКЌгаТШРыгк
ЃЈ5ЃЉЕчНтвЛЖЮЪБМфКѓЃЌгћЪЙШмвКЛжИДЕНЕчНтЧАЕФХЈЖШКЭЬхЛ§ЃЌПЩЭљЕчНтКѓЕФШмвКжаМгШыЃЈЛђЭЈШыЃЉвЛЖЈСПЕФ________ЃЈЬюзжФИЃЉ
A.NaClЙЬЬх B.NaClШмвК C.HClЦјЬх D.бЮЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЬхЛ§ПЩБфЕФУмБеШнЦїжаЃЌМгШывЛЖЈСПЕФXЁЂYЃЌЗЂЩњШчЯТЗДгІЃКmX(g)![]() nY(g) ІЄH=QKJЁЄmol-1ЁЃЗДгІДяЕНЦНКтЪБЃЌYЕФЮяжЪЕФСПХЈЖШгыЮТЖШЁЂЦјЬхЬхЛ§ЕФЙиЯЕШчЯТБэЫљЪОЃКЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
nY(g) ІЄH=QKJЁЄmol-1ЁЃЗДгІДяЕНЦНКтЪБЃЌYЕФЮяжЪЕФСПХЈЖШгыЮТЖШЁЂЦјЬхЬхЛ§ЕФЙиЯЕШчЯТБэЫљЪОЃКЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. ЮТЖШВЛБфЃЌбЙЧПдіДѓЃЌYЕФжЪСПЗжЪ§МѕаЁ
B. m>n
C. QЃМ0
D. ЬхЛ§ВЛБфЃЌЮТЖШЩ§ИпЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com