
����Ŀ����ҵ�����õ�ⱥ�ͺ�ʳ��ˮ���Ƶ���Ҫ������Ʒ��
��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ�� ___________________________��
��2����ⱥ��ʳ��ˮʱ��________����������ҺpH���
��3���͵�Դ���������ĵ缫Ϊ________�����õ��������Ʒ��________�����鷽��������Ϊ_______________�������漰�ķ�Ӧ����ʽ��__________________________��
��4�����һ��ʱ���ȡ��������Һ��ʵ�飬���н����д������________������ĸ��
A.�μ���ɫʯ����Һ����Һ�ʺ�ɫ
B.�μ��Ȼ�þ��Һ���а�ɫ��������
C.����ʯ��ʯ�������ݲ���
D.�ȼ��������ᣬ�ٵμ���������Һ������������˵����Һ�к���������
��5�����һ��ʱ�����ʹ��Һ�ָ������ǰ��Ũ�Ⱥ�����������������Һ�м��루��ͨ�룩һ������________������ĸ��
A.NaCl���� B.NaCl��Һ C.HCl���� D.����
���𰸡�2NaCl��2H2O![]() Cl2����H2����2NaOH �� ���� ���� ���۵⻯����ֽ���� Cl2��2KI=I2��2KCl BD C
Cl2����H2����2NaOH �� ���� ���� ���۵⻯����ֽ���� Cl2��2KI=I2��2KCl BD C
��������
��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ��2NaCl��2H2O![]() Cl2����H2����2NaOH����
Cl2����H2����2NaOH����
����2NaCl��2H2O![]() Cl2����H2����2NaOH��
Cl2����H2����2NaOH��
��2����ⱥ��ʳ��ˮʱ������������ʧ�����ͷų�����������ˮ�õ��������������ų�����������������������ҺpH���
��������
��3�����ӵ���ʱ���������Դ����������������ʧ�����ͷų��������������Դ�ĸ���������ˮ�õ��������������ų��������������������ķ���Ϊ����ʪ��ĵ��۵⻯����ֽ��������������ֽ������˵�������������������ķ�ӦΪCl2��2KI=I2��2KCl��
��Ϊ�����������������۵⻯����ֽ������Cl2��2KI=I2��2KCl��
��4�����һ��ʱ���ˮ�õ��������������ų�������������������Һ�Լ��ԣ�
A.�μ���ɫʯ����Һ����Һ����ɫ����A����
B.�μ��Ȼ�þ��Һ������������þ��ɫ��������B��ȷ��
C.ʯ��ʯΪ̼��ƣ�����Ӧ����C����
D.�Ȼ�����ǿ����ʣ�����Һ����ȫ����Ϊ�����Ӻ������ӣ��ȼ��������ᣬ�ٵμ���������Һ������������˵����Һ�к��������ӣ���D��ȷ��
��ѡBD��
��5�����ݷ�Ӧ2NaCl��2H2O![]() Cl2����H2����2NaOH���÷�Ӧ�൱��ԭ��Һ�м������Ȼ��⣬�����������Һ��ͨ��һ�������Ȼ������壬����ʹ��Һ�ָ������ǰ��Ũ�Ⱥ������
Cl2����H2����2NaOH���÷�Ӧ�൱��ԭ��Һ�м������Ȼ��⣬�����������Һ��ͨ��һ�������Ȼ������壬����ʹ��Һ�ָ������ǰ��Ũ�Ⱥ������
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������÷�Һ©�����з�����ǣ� ��
A. ������Ȼ�̼B. ���������ͱ���̼������Һ
C. ˮ���屽D. ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п������Ҫ��Zn��ZnO��SiO2��Fe2+��Cd2+��Mn2+����ҵ�Ͽ�ͨ������������һ��ȥ�������Ʊ���ϸ��������п���乤���������£�
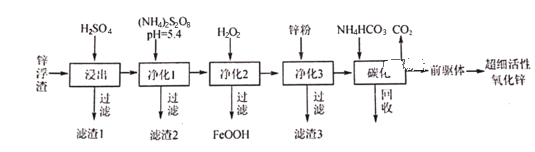
(1)����1�ijɷ�Ϊ___________��
(2)��S2O82���Ľṹʽ��ֻ����һ����OһO���Ǽ��Լ�����S�Ļ��ϼ�Ϊ___________����ҵ�ϳ��ö��Ե缫���(NH4)2SO4����(NH4)2S2O8(���������)�������缫��ӦʽΪ__________________������1��Ϊ�˽�Mn2+ת��ΪMnO2����ȥ��д���÷�Ӧ�����ӷ���ʽ��______________________��
(3)����3��Ŀ��_________________________________��
(4)̼��������Һ����Ҫ�ɷ�Ϊ___________��������ѭ��ʹ�õ�Ŀ��___________________��
(5)̼����50����У���ǰ���塱�Ļ�ѧʽΪZnCO3��2Zn(OH)2��H2O��д��̼���������ɡ�ǰ���塱�Ļ�ѧ����ʽ��__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1911�꣬¬ɪ������![]() ����ɢ��ʵ���������
����ɢ��ʵ���������
A.����ԭ����B.ԭ�ӽṹ�����Ѹ����ģ��
C.ԭ�ӽṹ������ģ��D.��������Ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���϶��������(�� ��)
A.ijԭ��K����ֻ��һ������
B.ijԭ��M���ϵĵ�����ΪL���ϵ�������4��
C.ij����M���Ϻ�L���ϵĵ�������ΪK���4��
D.ij���ӵĺ˵�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�к�ˮ��������Ӧ����ˮ�����з�����ԭ������ȫ�����е��ǣ� ��
A. ����������ʹ��ˮ���ηֳ���������
B. ����̫���ܣ�����ˮ����
C. ���ð�Ĥ�����÷�������ʹ��ˮ����
D. ����ˮͨ�����ӽ�����֬���Գ�ȥ�������η�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ԫ�صĵ��������ݣ���λ��kJ/mol�����ش�������⡣
Ԫ�ش��� | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
��1����������Ԫ���У�����ܴ���ͬһ�������Ԫ����_________����Ԫ�ط��ţ���SԪ���������_____��Ԫ��
��2����̬QԪ��ԭ�ӵļ۵����Ų�ʽ��____________��Q��Tͬ���ڡ�������QT��TԪ�صĻ��ϼ�Ϊ_______����һ�����ܽ���Q��T֮���ͬ����Ԫ����______�֡�
��3��������RT3�л�ѧ������Ϊ_______��RT3�������ӵļ��ι���Ϊ________��
��4������Ԫ���У���ѧ���ʺ�������������UԪ�ص���_____________
A���𡡡� B���롡����C��ﮡ�����D����������E��̼
��5��R��ij��������X�����ṹ��ͼ��ʾ����������a��0.566 nm��X�Ļ�ѧʽΪ_____����ʽ�����㾧��X���ܶ�(g��cm��3)_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺

(1)���Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��________(�����װ��ͼ����ĸ����ͬ)����ȥ����ˮ�е�Cl�������ʣ�ѡ��װ��________��
(2)�ӵ�ˮ�з����I2��ѡ��װ��________���÷��뷽��������Ϊ________��
(3)װ��A�Тٵ�������________����ˮ�ķ����Ǵ�________�ڽ�ˮ��װ��B�ڷ�ҺʱΪʹҺ��˳�����£��������⣬��Ӧ���еľ��������____��
(4)��ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
�����к�Ca2����Mg2����Fe3����SO42-�����ʣ���Ҫ�ᴿ������ۺ����á������ᴿ�IJ����У�
�ټ��������Na2CO3��Һ���ڼ��������BaCl2��Һ���ۼ��������NaOH��Һ���ܵ�����Һ��pH����7�����ܽ⡡���ˡ�������
��ȷ�IJ���˳����________(��ѡ����ĸ)��
a���ݢڢۢ٢ޢܢ� b���ݢ٢ڢۢޢܢ�
c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20��ʱ�����������ļס������ֹ������ʣ��ֱ���뵽ʢ��100gˮ���ձ��У���ֽ����������ͼ1�����ȵ�50��ʱ������ͼ2���ס����������ʵ��ܽ��������ͼ3������ͼʾ�ش��������⣺

��1��ͼ1��һ��Ϊ������Һ����_____��
��2��ͼ2�мס�������Һ���������������Ĵ�С��ϵΪ��___�ҡ������ڡ����ڡ�С�ڣ�
��3��ͼ3�б�ʾ�ҵ��ܽ��������____�������ߴ��룩��P���ʾ�ĺ�����_____��
��4����ͼ3֪��30��ʱ����20g��������20gˮ��������Һ��������������Ϊ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com