
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O.正极电极反应式为 .
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2 , 若将此反应设计成原电池,则负极所用电极材料为 , 当线路中转移0.4mol电子时,则被腐蚀铜的质量为g.
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 .
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
(4)如图是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,A极为电源(填“正”或“负”)极,写出A极的电极反应式: . 
【答案】
(1)PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O
(2)Cu;12.8
(3)B
(4)负极;CO﹣2e﹣+CO32﹣=2CO2
【解析】解:(1)放电时,正极上PbO2得电子,正极反应式为PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O,所以答案是:PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O;(2)该电池反应中,铜失电子发生氧化反应,作负极;负极反应式为Cu﹣2e﹣=Cu2+ , 则当线路中转移0.4mol电子时,反应的Cu为0.2mol,其质量为12.8g,所以答案是:Cu;12.8;(3)铝片和铜片插入浓HNO3溶液中,金属铝会钝化,金属铜和浓硝酸之间会发生自发的氧化还原反应,此时金属铜时负极,金属铝是正极; 插入稀NaOH溶液中,金属铜和它不反应,金属铝能和氢氧化钠发生自发的氧化还原反应,此时金属铝是负极,金属铜是正极,所以答案是:B;(4)CO具有还原性,在负极上发生氧化反应生成CO2 , 则A为燃料电池的负极,电解质为Li2CO3和Na2CO3的熔融混合物,则电极反应式为:CO﹣2e﹣+CO32﹣═2CO2 , 所以答案是:负;CO﹣2e﹣+CO32﹣=2CO2 .


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】已知:
①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是

A.反应②中的能量变化如图所示,则ΔH2=E1-E3
B.H2的燃烧热为241.8 kJ·mol-1
C.氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
D.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度线,配制成一定物质的量浓度的溶液
B.用燃着的酒精灯,点燃另一盏酒精灯
C.胶头滴管取完一种试液后,可直接取另一种不与其反应的试液
D.用玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的5种有机物(氢原子没有画出) 
(1)写出有机物(a)的习惯命名法的名称 .
(2)有机物(a)有一种同分异构体,写出其结构简式 .
(3)上述有机物中与(c)互为同分异构体的是(填代号).
(4)上述有机物中不能与溴水反应使其褪色的有(填代号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 细小颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)t1=s,画出以时间对温度的曲线图(纵轴表示时间,横轴表示温度). 
(2)利用所画的曲线图,总结并得出的关于温度影响反应速率的结论是;
(3)t1t4(填“>”或“<”),原因是 . t2t3(填“>”或“<”),原因是;
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
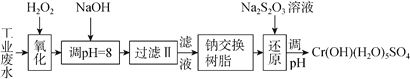
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是___(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子___(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)在还原过程中,每消耗172.8gCr2O72- 转移4.8mole-,则还原过程中该反应离子方程式为____。(已知在氧化过程中Cr3+转化为Cr2O72- )
(Ⅱ)酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理该废水,阳极反应是Fe-2e-![]() Fe2+,阴极反应式是2H++2e-
Fe2+,阴极反应式是2H++2e-![]() H2↑。
H2↑。
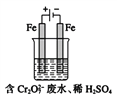
(1)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是_____。
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为___________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因______________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化成沉淀的质量是_______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com