
【题目】已知K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。
【答案】ⅴ 变浅 根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深 增大(减少)生成物浓度,平衡逆向(正向)移动 浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度 14HCl + K2CrO7 ==3Cl2↑+ 2CrCl3 + 2KCl+7H2O
【解析】
K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+,增大反应物浓度,平衡正向移动,增大生成物浓度,平衡逆向移动,但平衡移动后溶液的颜色如何变化,不是取决于平衡移动的方向,而是取决于平衡移动前后,有色离子浓度的变化。另外,如果加入的物质对平衡的影响是多方面的,则应综合考虑各种因素对平衡或离子浓度产生的影响。如K2CrO7 溶液中加入浓盐酸,一方面,浓盐酸中的H+对平衡体系(
+2H+,增大反应物浓度,平衡正向移动,增大生成物浓度,平衡逆向移动,但平衡移动后溶液的颜色如何变化,不是取决于平衡移动的方向,而是取决于平衡移动前后,有色离子浓度的变化。另外,如果加入的物质对平衡的影响是多方面的,则应综合考虑各种因素对平衡或离子浓度产生的影响。如K2CrO7 溶液中加入浓盐酸,一方面,浓盐酸中的H+对平衡体系(![]() +H2O
+H2O![]() 2
2![]() +2H+)会产生影响,另一方面,K2CrO7 会被Cl-还原,对c(
+2H+)会产生影响,另一方面,K2CrO7 会被Cl-还原,对c(![]() )也会产生影响。
)也会产生影响。
Ⅰ.(1)ⅰ~ⅴ中,ⅰ为增大反应物浓度,ⅱ~ⅳ为增大生成物浓度,只有ⅴ符合题意,所以依据减少生成物浓度可导致平衡移动的原理设计的是ⅴ。答案为:ⅴ;
(2)加入该Ba(NO3)2溶液后,溶液中的![]() 与Ba2+反应生成BaCrO4黄色沉淀,减少溶液中的c(
与Ba2+反应生成BaCrO4黄色沉淀,减少溶液中的c(![]() ),从而减少溶液中的c(
),从而减少溶液中的c(![]() ),溶液颜色将变浅。答案为:变浅;
),溶液颜色将变浅。答案为:变浅;
Ⅱ.(1)实验ⅰ,虽然平衡右移,但由于增大了c(![]() ),最终溶液中的c(
),最终溶液中的c(![]() )未减反增,从而得出没有观察到预期现象的原因是根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深。答案为:根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深;
)未减反增,从而得出没有观察到预期现象的原因是根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深。答案为:根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深;
(2)实验ⅲ,增大生成物中H+浓度,平衡逆向移动;实验ⅴ,加入的OH-与H+反应生成H2O,减少生成物中H+浓度,平衡正向移动。所以,通过实验ⅲ和ⅴ得出的结论为增大(减少)生成物浓度,平衡逆向(正向)移动。答案为:增大(减少)生成物浓度,平衡逆向(正向)移动;
(3)实验ⅳ无明显现象,表明浓盐酸的加入,对平衡体系中c(![]() )的影响不大,可能的原因是浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度。答案为:浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度;
)的影响不大,可能的原因是浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度。答案为:浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度;
(4)取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色,则生成CrCl3,同时有黄绿色气体生成,表明生成了Cl2。该变化的化学方程式为14HCl + K2CrO7 ==3Cl2↑+ 2CrCl3 + 2KCl+7H2O。答案为:14HCl + K2CrO7 ==3Cl2↑+ 2CrCl3 + 2KCl+7H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是__g;
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为__mol/L;
(3)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了__性和__性,则56gFe参加反应时,被还原的HNO3为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
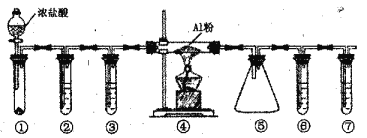
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。已知d点所示的溶液中,钠元素与氯元素的物质的量相等,下列选项正确的是( )
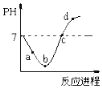
A.a点时,已经滴入NaOH溶液
B.b点所示的溶液中,只存在两种分子
C.a、b、c、d四个点当中,d点水的电离程度最大
D.c点所示的溶液中,c(Na+)=c(Cl-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
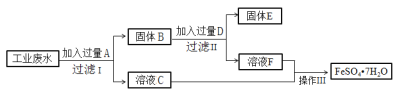
回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是![]()
A.实验室欲配制![]() 的
的![]() 溶液,可用
溶液,可用![]() 胆矾及相应容器配制
胆矾及相应容器配制
B.将适量![]() 饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体
饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体
C.实验室中从海带里提取碘的过程是:灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.用分液漏斗、烧杯、铁架台![]() 带铁圈
带铁圈![]() 、饱和
、饱和![]() 溶液可除去乙酸乙酯中的乙酸
溶液可除去乙酸乙酯中的乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生能源、生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)甲醇的沸点比甲醛的高,其主要原因是_____;
(2)向含Cu2+的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为深蓝色,反应过程中涉及的离子方程式为:___、___。写出检验Fe3+生成的配离子的化学式:__,该配离子的配位体是___。
(3)已知NH3·H2O的电离方程式为NH3·H2ONH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______(填序号)。
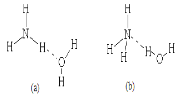
(4)请回答下列问题:
①下列现象和应用与电子跃迁无关的是______。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.石墨导电
②A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有___个σ键。
③利用CO可以合成化工原料COCl2,其中COCl2分子的结构式为![]() ,COCl2分子内含有____(填标号);
,COCl2分子内含有____(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写,正确的有( )
①铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
②氯气与水反应:Cl2+2H2O=2H++Cl-+ClO-
③向硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
④铜与硝酸银溶液:Cu+Ag+=Cu2++Ag
⑤NaOH溶液吸收少量CO2:2OH-+CO2=CO32-+H2O
⑥稀硫酸与氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
A.1个B.2个C.3个D.4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com