
����Ŀ��pH�ڱ�ʾ��Һ������Է�������Ҫ��Ӧ�ã��밴Ҫ��������
��1�������£�pH=12��NaOH��Һ����Ũ��c��NaOH��=mol/L
��2�������£�ijһԪ������Һ��pH=1����Ũ��0.1mol/L�����������������=������
��3�������£���100mL 0.1mol/L������Һ��50mL 0.2mol/LNaOH��Һ���Ȼ�Ϻ���Һ��������ԡ��������ԡ������ԡ�������ԭ��������������ص����ӷ���ʽ����
��4��25��ʱ�������ΪVa��pH=a��ijһԪǿ��HA�����ΪVb��pH=b��ijһԪǿ��BOH���ǡ���кͣ�����֪Va��Vb��a=0.5b���� a��ȡֵ��Χ�� ��
���𰸡�
��1��10��2mol/L
��2����
��3�����ԣ�CH3COO��+H2O?CH3COOH+OH��
��4��3.5��a�� ![]()
���������⣺��1�������£�pH=12��NaOH��Һ�д������ӻ�������c��H+��c��OH����=10��14 �� C��OH����= ![]() =10��2mol/L����Ũ��c��NaOH��=10��2mol/L��
=10��2mol/L����Ũ��c��NaOH��=10��2mol/L��
���Դ��ǣ�10��2mol/L��
��2.�������£�ijһԪ������Һ�д��ڵ���ƽ�⣬��Һ��pH=1��������Ũ��Ϊ0.1mol/L������Ũ�ȴ���0.1mol/L��
���Դ��ǣ�����
��3.�������£���100mL 0.1mol/L������Һ��50mL 0.2mol/LNaOH��Һ���Ȼ�Ϻ������ʵ���=0.1mol/L��0.1L=0.01mol��50mL 0.2mol/LNaOH��Һ���������ʵ���=0.050L��0.2mol/L=0.01mol������ǡ����ȫ��Ӧ���ɴ����ƣ����������ʧ���������ӣ�ˮ��Һ��ˮ���Լ��ԣ�CH3COO��+H2OCH3COOH+OH�� ��
���Դ��ǣ����ԣ�CH3COO��+H2OCH3COOH+OH����
��4.���ᡢ���һԪǿ����ʣ�pH=a��һԪǿ����Һ��������Ũ��=10��a mol/L��pH=b��һԪǿ��������������Ũ��=10 b��14 mol/L������ǡ�÷�Ӧʱ����ͼ�����ʵ�����ȣ�����
10��a mol/L��VaL=10 b��14 mol/L��VbL�� ![]()
= ![]() =10 a+b��14 ��
=10 a+b��14 ��
Va��Vb��
����10 a+b��14��1��
����a+b��14��
��a=0.5b��
����3a��14��
����a�� ![]() ��
��
b��7��a=0.5b��0.5��7=3.5��
���Եõ���3.5��a�� ![]() ��
��
���Դ��ǣ�3.5��a�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�صļ����Ӷ�����10���������Ҷ�ӦԪ�ػ��ϼ���ԭ�������Ĺ�ϵ��ͼ��ʾ��

��1����A��E����Ԫ�ص�Ԫ�ط��������±�����ȷ��λ���ϡ�________
������ ���� | IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
һ | ||||||||
�� | ||||||||
�� | ||||||||
��2��A��B��C��D��E��F����Ԫ���зǽ�������ǿ����____________(��Ԫ�ط���)��B��D��Ԫ�ؿ������ԭ�Ӹ�����Ϊ1��1�����ӻ����д�������ӻ�����ĵ���ʽ��______��A��B��Ԫ�ض�Ӧ����̬�⻯����ȶ���ǿ����ϵ��________________(�û�ѧʽ��ʾ)��
��3��д��D��F��Ԫ�ص�����������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ��________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ڸ���������һ���ܴ���������ǣ� ��
A.�μӼ����Ժ�ɫ����Һ�У�Na+��K+��Cl����ClO��
B.����KSCN��Ѫ��ɫ����Һ�У�Na+��Mg2+��SO42����Br��
C.![]() =1.0��1012mol/L����Һ�У�K+��Na+��NO3����HCO3��
=1.0��1012mol/L����Һ�У�K+��Na+��NO3����HCO3��
D.��ˮ�����c��H+��=1.0��10��13mol/L����Һ�У�NH4+��Fe2+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������淴Ӧ��ƽ��ı䷴Ӧ��������仯������ȷ���ǣ� �� 
A.��100mL 0.1mol/L������Һ����������ƾ����������ҺpH�ı仯����ͼ
B.��FeCl3��Һ��KSCN��Һ��Ϻ�Ӧ��ƽ�������Һ���������KCl������c��Fe3+���ı仯����ͼ
C.�ܱ������н���N2��g��+3H2��g��2NH3��g����Ӧ�ﵽƽ����ֺ��º�ѹ�����£���ͨ��ϡ������Ar�Ĺ�����H2��ת���ʱ仯����ͼ
D.�ܱ������н���CH3OCH3��g��+3H2O��g��6H2��g��+2CO2��g����H��0�ﵽƽ����ֺ�ѹ�����£��������¶ȹ�����CH3OCH3��ת���ʱ仯����ͼ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��з�Ӧ��X��g��+2Y��g��2Z��g����H��0����ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ��ǣ� ��
A.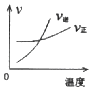
B.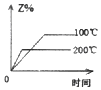
C.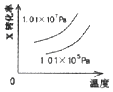
D.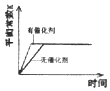
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڴ��������
A. ҽ�þƾ� B. �ɱ� D.�ӵ�ʳ�� C. Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaCl2��Һ��ͨ��SO2����Һ��������֧�Թ��У���һ���м���NaOH��Һ�����ְ�ɫ����A����һ��ͨ������Cl2��������ɫ����B���Իش��������⣺
��1����������SO2��ˮ�ķ�Ӧ��BaCl2��Һ��ͨ��SO2������������������������������������Ӧ����Ҳ����������Ӧ�������������˴�ӦΪ ��ԭ���� ��
��2������A�Ļ�ѧʽΪ ���ó����ܷ�����ϡ��� _��
��3��д�����ɳ���B�����ӷ���ʽ�� ��
��4������2.33 g����B�������ı�״���µ�Cl2 mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�����ʳƷ��������������ͼ��ʾ�������г�װ����ʡ�ԣ���ҩƷ��̽����������������ķ�Ӧ�������������ijɷ֣���֪����Һ�����¶ȣ�NO2��21�棻��152�� 
�ش��������⣺
��1��Ϊ�˼���װ��A�����ɵ�����������������˳��Ϊ�������������ӣ���A��C������ ��
��2����װ���������������еIJ�������ʵ�鿪ʼʱͨ��N2�������� ��
��3���رյ���K1 �� ��Һ©������������70%�����A�в�������ɫ���壮ȷ��A�в����������к���NO�����ݵ���������װ��E�������� ��
��4����������ʵ�飬д���÷�Ӧ�Ļ�ѧ����ʽ�� �� ���û��װ��C������֤������ɵ�Ӱ���� ��
��5��ʵ��������ͨ��N2���������������D��ͨ�����O2 �� ��װ��B�з�����Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о�������ʵ�����к���Ҫ�����á��±��г�������������Ԫ�������ڱ��е�λ�á�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� |
��ش�
��1�������Ԫ���л�ѧ��������õ���________��(��Ԫ�ط���)
��2��д����Ԫ�ص��ʵ�һ����;_____________________��
��3��д����Ԫ������������Ӧˮ����Ļ�ѧʽ______________________��
��4��д��������Ԫ���γɵĻ�����ĵ���ʽ______________________��
��5������������������Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ����_______________(�ѧʽ)��
��6�� ��������������Ԫ�ذ�ԭ�Ӱ뾶�ɴ�С��˳������Ϊ___________(��Ԫ�ط���)��
��7����������������Ԫ�صļ����Ӱ뾶�ɴ�С��˳������Ϊ___________(�����ӷ���)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com