
| ���� | CH4 | C2H2 | H2 |
| ȼ����/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A��C��C����Ϊ796.0 kJ/mol | ||
| B��2CH4��g��+2O2��g���T2H2O��l����H=-890.3 kJ/mol | ||
C��H2��g��+
| ||
| D��2CH4��g���TC2H2��g��+3H2��g����H=-376.4 kJ/mol |
| 5 |
| 2 |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ԭ�� | B���ǻ� | C������ | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A����X�����ţ��������B�缫�����·����A�缫 |
| B����X��ͭ������A�缫�ĵ缫��Ӧʽ�ǣ�Zn2++2e-�TZn |
| C����X��ʯī�������ҳ���Һ��pH���С |
| D����X��п������A�缫���������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | 1.8��10-5 | 4.9��10-10 | Ka1=4.3��10-7 Ka2=5.6��10-11 |
| A�������ʵ���Ũ�ȵĸ���Һ pH ��ϵΪ��pH�� NaCN����pH��Na2CO3����pH�� CH3COONa�� |
| B��Ũ�Ⱦ�Ϊ0.2mol/L NaHCO3�� Na2CO3��Һ�У����ڵ����������ͬ |
| C��0.4mol?L-1 HCN ��Һ�� 0.2mol?L-1 NaOH ��Һ�������Ϻ�������Һ�У�c��Na+����c��OH-����c��H+�� |
| D��25��ʱ��pH=4��Ũ�Ⱦ�Ϊ0.1 mol?L-1��CH3COOH��CH3COONa�����Һ�У�c��Na+��+c��H+����c��CH3COO-��+c��CH3COOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
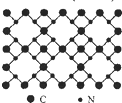 ����������ѧ���㣬����̼�ṹ�����֣�����һ�ֵ���̼Ӳ�ȳ������ʯ���壬��Ϊ��һָ�ij�Ӳ�²��ϣ���֪�õ���̼�Ķ�ά����ṹ��ͼ��ʾ�������йص���̼��˵����ȷ���ǣ�������
����������ѧ���㣬����̼�ṹ�����֣�����һ�ֵ���̼Ӳ�ȳ������ʯ���壬��Ϊ��һָ�ij�Ӳ�²��ϣ���֪�õ���̼�Ķ�ά����ṹ��ͼ��ʾ�������йص���̼��˵����ȷ���ǣ�������| A������̼���ڷ��Ӿ��� |
| B������̼�ķ���ʽΪC3N4 |
| C���þ����е�̼����ԭ�Ӻ��ⶼ����8�����ȶ��ṹ |
| D��ÿ��̼ԭ�����ĸ���ԭ��������ÿ����ԭ��������̼ԭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��2Na+MgCl2
| ||||
B��MgCl2 ���ۻ���
| ||||
C��2MgO
| ||||
D��MgO+C
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ư뵼��IJ��� |
| B�����¡���ʴ�ĺϽ���� |
| C����ũҩ�IJ��� |
| D���ƴ����IJ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ���� | �ж� |
| A | Si�����õİ뵼������ | Si�������Ʊ����ά |
| B | ��δ֪��Һ����ϡ������Ȼ�����Һ�г������� | ˵����δ֪��Һ�϶�����SO42- |
| C | �ڽ����˳����У������˳��Fe��H��Cu��Hg��Ag | Ҫ�ӿ�ʯ��ұ���õ��������ʣ�������ֻ����ȣ�������ͭ�����û�ԭ�� |
| D | п�̸ɵ��̼����������MnO2�������� | п�̸ɵ���Ƕ��ε�أ����Է������ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com