
【题目】有机物G可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示。

已知:
①通常在同一碳原子上连有两个烃基不稳定,易脱水形成羰基
②醛能发生羟醛缩合反应,最终脱水生成不饱和醛:

③
请回答:
(1)A生成B的反应类型为_________,B中含有的官能团名称为_________。
(2)写出两个符合下列条件的A的同分异构体结构简式________。
①能与氯化铁溶液发生显色反应
②核磁共振氢谱显示分子中苯环上有两种不同化学环境的氢原子
(3)化合物C的结构简式为_________。
(4)D
![]()
E的化学方程式为__________。
(5)1molG在一定条件下与足量H2充分反应,需要消耗H2__________mol。
(6)![]() 可由
可由![]() 和有机物H分子间脱去一分子水而得,则H的名称为______;通常采用
和有机物H分子间脱去一分子水而得,则H的名称为______;通常采用![]() 为原料合成
为原料合成![]() ,请参照题目路线图设计该合成路线______(无几时机任选)。
,请参照题目路线图设计该合成路线______(无几时机任选)。
【答案】 取代反应(或氯代反应) (酚)羟基、氯原子 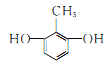 、
、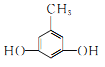 、
、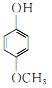 、
、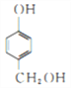 (任意写出其中2个,)
(任意写出其中2个,) 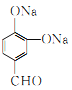
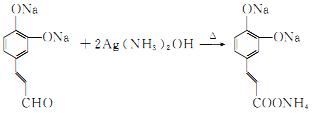 +2Ag↓+3NH3+H2O 5 乙二醇
+2Ag↓+3NH3+H2O 5 乙二醇 
【解析】![]() 在H2O2的作用下发生信息③的反应,生成的A为
在H2O2的作用下发生信息③的反应,生成的A为![]() ,A再在光照条件下与氯气发生取代反应生成B,B在NaOH的水溶液中发生卤代烃的水解生成C,再结合C和CH3CHO可以发生羟醛缩合反应,最终脱水生成不饱和醛D,则B为
,A再在光照条件下与氯气发生取代反应生成B,B在NaOH的水溶液中发生卤代烃的水解生成C,再结合C和CH3CHO可以发生羟醛缩合反应,最终脱水生成不饱和醛D,则B为![]() ,C为
,C为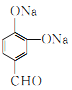 ,D为
,D为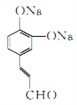 ;D再发生银镜反应生成的E为
;D再发生银镜反应生成的E为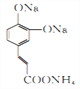 ,E酸化后得到的F为
,E酸化后得到的F为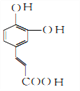 ;
;
(1),A再在光照条件下与氯气发生取代反应生成B;B为![]() ,分子中含有的官能团名称为(酚)羟基、氯原子;
,分子中含有的官能团名称为(酚)羟基、氯原子;
(2)①能与氯化铁溶液发生显色反应,说明分子结构中含有酚羟基;②核磁共振氢谱显示分子中苯环上有两种不同化学环境的氢原子,说明分子结构中对位上有两个不同取代基,或苯环上有两个酚羟基和一个甲基,且酚羟基为对称位置,满足条件的![]() 同分异构体有
同分异构体有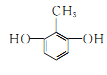 、
、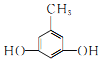 、
、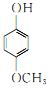 、
、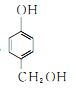 ;
;
(3)化合物C的结构简式为 ;
;
(4)D发生银镜反应生成的E为 ,反应化学方程式为
,反应化学方程式为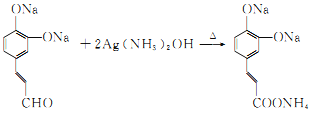 +2Ag↓+3NH3/span>+H2O;
+2Ag↓+3NH3/span>+H2O;
(5)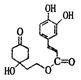 中苯环、碳碳双键和羰基可以与氢气发生加成反应,则1molG在一定条件下与足量H2充分反应,需要消耗H2的物质的量为5mol;
中苯环、碳碳双键和羰基可以与氢气发生加成反应,则1molG在一定条件下与足量H2充分反应,需要消耗H2的物质的量为5mol;
(6)![]() 可由
可由![]() 和有机物H分子间脱去一分子水而得,根据原子守恒和碳架结构不变,可知H的结构简式为HOCH2CH2OH,名称为乙二醇;采用
和有机物H分子间脱去一分子水而得,根据原子守恒和碳架结构不变,可知H的结构简式为HOCH2CH2OH,名称为乙二醇;采用![]() 为原料合成
为原料合成![]() 的流程为
的流程为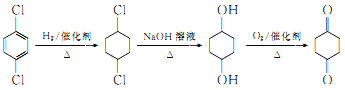 。
。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也。”天为上,所以中国古代通常称青金石为帝王石,明淸尤重。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)铝元素基态原子的外围电子轨道表示式为_____________,基态硅原子核外电子占有的原子轨道数为_____________个,氧、硫、氯的第一电离能由大到小顺序为________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子空间构型为__________。
(3)第四周期中,与氯原子未成对电子数相同的金属元素有_______种。
(4)晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为____________(填化学式)。
(5)下表是一组物质的沸点数据:
有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
相对分子质量 | 32 | 42 | 34 |
沸点/℃ | 64.7 | -47.7 | -78.2 |
若只考虑相对分子质量,甲醇沸点应低于-78.2℃,甲醇沸点高的原因是________。
丙烯中含有的α键与π键个数之比为______________。
(6)铝单质为面心立方晶体,其晶胞结构如图,晶胞参数qcm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,该晶体的空间利用率为_______________(只要求列算式,不必计算出数值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述不正确的是

A. 图1能验证乙炔的还原性
B. 图2可用于实验室制O2
C. 图3可以看出催化剂不能改变反应的焓变
D. 图4表示KNO3的溶解度曲线,图中a点所表示的溶液时80℃时KNO3的不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。

(1)该合金的化学式为__________________;
(2)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为:______________________________________。
(3)下列关于该贮氢材料及氢气的说法中,正确的是_________( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(4)晶体铜是面心立方堆积,在铜的一个晶胞中,把顶点上的铜原子换成Au,可得一种合金,该合金也具有储氢功能,储氢时,氢原子进入到Au和Cu原子构成的的四面体空隙中,则达到最大储氢量的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是
A. 稀硫酸 B. CuSO4溶液 C. Fe2(SO4)3溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.15gNa与H2O反应,得到100mL溶液,试计算:
(1)钠失去电子的物质的量。________________
(2)生成气体的体积在标准状况下是多少毫升?____________
(3)反应后所得溶液中溶质的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关。下列说法不正确的是
A. 纤维素在人体内水解最终生成葡萄糖
B. 羊绒衫的主要成分是天然纤维
C. 新型能源页岩气的主要成分是甲烷
D. 用太阳能分解水制氢气可减少碳排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一价离子组成四种盐,AC、BD、AD、BC的1mol·L-1 溶液,在室温下前两种溶液的pH=7,第三种溶液的pH >7,最后一种溶液的pH< 7,则。
A | B | C | D | |
碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com