
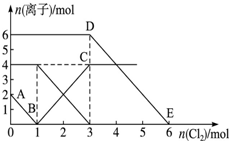
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3mol |
| C、线段AB表示Fe2+被氯气氧化 |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |


科目:高中化学 来源: 题型:
| A、熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体 |
| B、单质熔点97.81℃,是热和电的良导体,该晶体最可能是分子晶体 |
| C、SiO2晶体属于原子晶体,1mol的SiO2晶体含有4NA的Si-O键(NA为阿伏伽德罗常数) |
| D、固态金属单质都是金属晶体,金属晶体含有金属键.非金属单质晶体都是分子晶体,分子晶体主要含有共价键,范德华力,有些分子晶体还含有氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是含有一定数目粒子的集合体 |
| B、摩尔质量就是该物质的相对分子质量或相对原子质量 |
| C、单位物质的量的物质所占的体积就是气体摩尔体积 |
| D、40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+与I-在水溶液中不能大量共存 |
| B、氧化性:Cl2>Br2>I2 |
| C、将足量Br2加入到FeCl2溶液中,离子反应方程式为Br2+2Cl-═2Br-+Cl2 |
| D、将Cl2通入到FeBr2溶液中,Cl2应优先氧化Fe2+,再氧化Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| D、氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 放电 |
| A、上述反应为可逆反应 |
| B、放电时,电池的正极反应为CoO2+Li++e-=LiCoO2 |
| C、锂离子电池可以用水溶液来做电解质溶液 |
| D、锂离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
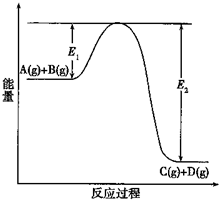 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com