
| A. | K2CO3和KCl | B. | NaCl和Na2CO3 | C. | NaCl和MgCl2 | D. | NaCl和KCl |
分析 只能用焰色反应进行鉴别,则选项中物质不能利用阴离子鉴别,且阳离子不同,阳离子利用化学反应不能鉴别,以此来解答.
解答 解:A.利用盐酸可鉴别,加盐酸生成无色气体的为碳酸钾,无现象的为氯化钾,故A不选;
B.可加入盐酸鉴别,碳酸钠生成二氧化碳气体,氯化钠无现象,故B不选;
C.可加入氢氧化钠溶液鉴别,氯化镁生成沉淀,故C不选;
D.阴离子均为氯离子,只能利用焰色反应检验,焰色为黄色的为氯化钠,则另一物质为氯化钾,故D选.
故选D.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、反应中的不同现象为解答的关键,注意焰色反应为物理变化,明确常见金属的焰色反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:实验题
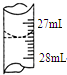 欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA | |
| B. | 在标准状况下,1 mol H2O的体积可能是22.4 L | |
| C. | 当温度高于0℃时,一定量任何气体的体积都大于22.4 L | |
| D. | 标况下,某气体的体积为22.4 L,则该气体的物质的量为1 mol,所含的分子数目约为:6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 在研究原子结构的过程中建立起的各种模型属于思维模型 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com