
����Ŀ��Ϊ��֤������Cl2>Fe3��>SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г������ͼ��м���װ�����ԣ��������Ѽ���)��
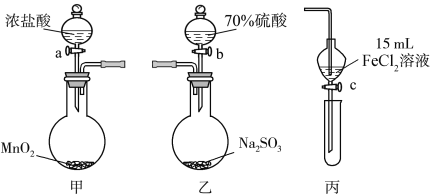
ʵ�鲽�裺
1���ڼ�װ���У�����a�����ȣ���װ���г�������ɫ����ʱ�����װ�����ӡ�
2������װ����FeCl2��Һ���ʱ��ֹͣ���ȡ�
3������c��ʹԼ2 mL����Һ�����Թ��У�������Һ�е����ӡ�
4������װ���У�����b���������ž������в���������ͨ��������װ�ñ�ƺ����Һ�У�һ��ʱ���ֹͣ��
5�����±����Թܣ�����c��ʹԼ2 mL����Һ�����Թ��У�������Һ�е����ӡ�
�ش��������⣺
(1)���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
(2)��70%��������ȡSO2����Ӧ���ʱ���98%������죬ԭ����______________��
(3)ʵ���У�֤��������Fe3����SO2�����ӷ���ʽΪ_________________________��
(4)�Т�����ͬѧ�ֱ����������ʵ�飬ʵ�������£�
����3��Һ�к��е����� | ����5��Һ�к��е����� | |
�� | ����Fe3������Fe2�� | ��SO |
�� | ��Fe3����Fe2�� | ��SO |
�� | ��Fe3����Fe2�� | ��Fe2�� |
����ʵ����һ���ܹ�֤��������Cl2>Fe3��>SO2����________(�����)��
���𰸡�(1)MnO2��4HCl(Ũ) ![]() MnCl2��2H2O��Cl2��
MnCl2��2H2O��Cl2��
(2)70%��������c(H��)��98%�������еĴ�
(3)2Fe3����SO2��2H2O===2Fe2����SO![]() ��4H�� (4)��
��4H�� (4)��
��������(1)�ڼ��ȵ������¶�����������Ũ�����������������Լ��з�����Ӧ�Ļ�ѧ����ʽΪMnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2����(2)70%��������c(H��)��98%��������c(H��)��������Ũ�ȴ�Ӧ���ʿ졣(3)�����Ӿ��������ԣ��ܰ�SO2�����������ᣬ��Ӧ�����ӷ���ʽΪ2Fe3����SO2��2H2O===2Fe2����SO
MnCl2��2H2O��Cl2����(2)70%��������c(H��)��98%��������c(H��)��������Ũ�ȴ�Ӧ���ʿ졣(3)�����Ӿ��������ԣ��ܰ�SO2�����������ᣬ��Ӧ�����ӷ���ʽΪ2Fe3����SO2��2H2O===2Fe2����SO![]() ��4H����(4)����3��Һ�������������ɣ�˵�����������������������������ӡ�������������������ǿ����������������Կ�֪��������Cl2>Fe3��������ʵ���м���Fe3������Fe2����˵���������㣬����SO2��Ӧ��ֻ�������ӡ����ڲ���5��Һ�к���SO
��4H����(4)����3��Һ�������������ɣ�˵�����������������������������ӡ�������������������ǿ����������������Կ�֪��������Cl2>Fe3��������ʵ���м���Fe3������Fe2����˵���������㣬����SO2��Ӧ��ֻ�������ӡ����ڲ���5��Һ�к���SO![]() ����˵�������Ӱ�SO2�������������ᣬ���������Fe3��>SO2������ʵ������Fe3����Fe2���������ų������Ƿ��������ʹ����5��Һ�к���SO
����˵�������Ӱ�SO2�������������ᣬ���������Fe3��>SO2������ʵ������Fe3����Fe2���������ų������Ƿ��������ʹ����5��Һ�к���SO![]() ��Ҳ����˵���DZ������������ģ�������֤��������Fe3��>SO2������ʵ������Fe3����Fe2������Ȼ����˵�������Ƿ�������������ڲ���5��Һ�к����������ӣ���˵���ڷ�Ӧ�������ӱ�SO2��ԭ�����Կ���֤��������Fe3��>SO2����ѡ��
��Ҳ����˵���DZ������������ģ�������֤��������Fe3��>SO2������ʵ������Fe3����Fe2������Ȼ����˵�������Ƿ�������������ڲ���5��Һ�к����������ӣ���˵���ڷ�Ӧ�������ӱ�SO2��ԭ�����Կ���֤��������Fe3��>SO2����ѡ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���������ڰ�ˮ�γ�[Ni(NH3)6]SO4��ɫ��Һ��[Ni(NH3)6]SO4�������ӵĿռ乹����________��
(2)��[Ni(NH3)6]2����Ni2����NH3֮���γɵĻ�ѧ����Ϊ________���ṩ�µ��ӶԵijɼ�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ��͵�FeCl3��Һ��ȡFe��OH��3���壬��ȷ�IJ����ǣ� ��
A.��FeCl3��Һ��������ˮ��
B.��FeCl3��Һ������ˮ�У������ػ�ɫҺ��
C.��FeCl3��Һ���˷�ˮ�У���������������ɺ��ɫҺ��
D.��FeCl3��Һ���˷�ˮ�У���������������ɺ��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к��У���Na������Ba2������Cl������Br������SO![]() ����SO
����SO![]() �е�һ�ֻ��֣����ν�������ʵ�飬��ÿ�����ӵ��Լ����������۲쵽���������±���ʾ��
�е�һ�ֻ��֣����ν�������ʵ�飬��ÿ�����ӵ��Լ����������۲쵽���������±���ʾ��
���� | �� �� | �� �� |
�� | ��pH��ֽ���� | ��Һ��pH����7 |
�� | ����Һ�еμ���ˮ���ټ���CCl4������ | CCl4��ʳ�ɫ |
�� | ���������Һ�м���Ba(NO3)2��Һ��ϡHNO3 | �а�ɫ�������� |
�� | ���ˣ�����Һ�м���AgNO3��Һ��ϡHNO3 | �а�ɫ�������� |
����ʵ�������ȷ����( )
A���϶����е������Ǣ٢ܢ�
B���϶�û�е������Ǣڢ�
C�����ܺ��е������Ǣ٢ڢ�
D������ȷ���������Ǣ٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H����OH����H2O����ʾ�Ļ�ѧ��Ӧ��
A. ������þ��ϡ���ᷴӦ B. Ba(OH)2��Һ����ϡ������
C. ����ʯ��ˮ��ϡ���ᷴӦ D. ������̼ͨ�����ʯ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ��ɱ����������������ʱ�����һЩ����Ӱ�죬������ǿ�ʼ�о�һЩ��������ˮ��������ijѧϰС��������Ϸ���NCl3����Ϊɱ������������С��������ͼ��ʾ��װ���Ʊ�NCl3����̽��NCl3��Ư���ԡ�

NCl3������������£�
�������� | �Ʊ�ԭ�� | ��ѧ���� |
��ɫ��״Һ�壬�۵�Ϊ��40�����е�Ϊ71������������ˮ���������л��ܼ����ܶ�Ϊ1.65 g/mL | Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ | 95����ը����ˮ������ˮ��Ӧ |
�ش��������⣺
����ʵ��Ŀ�ģ��ӿ����ӵ�˳��Ϊ
1�� �� ��2��3 ��6��7�� �� �� ��
��2��Cװ�������� ��
��3��Bװ���з�����Ӧ�Ļ�ѧ����ʽΪ ����Bװ��������ƿ�г��ֽ϶���״Һ��رսӿ�2���Ļ���������ˮԡ���ȵ��¶�Ϊ ��
��4����Fװ�õ���ƿ���н϶��ɫ��״Һ�����ʱ���ø���ྻ�IJ�����պȡ��Һ��ε�����ĺ�ɫʯ����ֽ�ϣ���ֽ����ɫ����ȡ��Һ�����50-60����ˮ�У�Ƭ�̺�ȡ����ˮ�ٵε�����ĺ�ɫʯ����ֽ�ϣ���ֽ�ȱ�������ɫ��д���й���ѧ��Ӧ����ʽ������ʵ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52 gþͭ�Ͻ���ȫ�ܽ���50 mL�ܶ�Ϊ1.40 g��mL��1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������ 1 120 mL(��״��)����Ӧ�����Һ�м���1.0 mol��L��1NaOH��Һ������������ȫ������ʱ���õ�2.54 g������������������⣺
��1���úϽ���þ��ͭ�����ʵ���֮���� ��
��2��NO2��N2O4�Ļ�������У�NO2����������� ��
��3���õ�2.54 g����ʱ������NaOH��Һ������� mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H++OH��=H2O��ʾ�Ļ�ѧ����ʽ�ǣ� ��
A.����������Һ����ᷴӦ
B.�������������ᷴӦ
C.�������������ᷴӦ
D.��������������������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ��(��Ҫ�ɷ�CaSO4������SiO2��Al2O3��)Ϊԭ�Ͽ��Ʊ�����CaCO3������ͼ���¡�
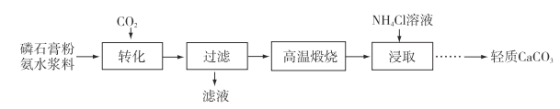
(1)����������ͨ��CO2��������Һ��pH��c(SO42��)��ʱ��仯������ͼ����ҺpH>11ʱCaSO4ת�������ӷ���ʽΪ________���������ת�����ʵĴ�ʩ��________(�����)��

A�����转��
B�����Ƚ�����100 ��
C������ˮŨ��
D����СCO2ͨ������
(2)����ҺpH�ӽ�6.5ʱ�����˲�ϴ�ӹ��塣��Һ�����ʵ���Ũ����������������Ϊ________��__________(�ѧʽ)������ϴ���Ƿ���ȫ�ķ�����_____________________��
(3)�ڳ��������У���NH4Cl��Һ��ȡ�������յĹ��壬���Ž�ȡҺ�¶���������Һ��c(Ca2��)�����ԭ����__________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com