
【题目】自来水常用二氧化氯(ClO2)来杀菌消毒,它能转化为可溶性氯化物,市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售,为辨别纯净水的真伪,你想选用的化学试剂是( )
A.氯化钡溶液B.石蕊试液C.硝酸银溶液D.氢氧化钠溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法正确的是( )
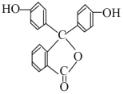
A. 酚酞分子中的所有碳原子在同一平面上 B. 酚酞的分子式为C20H14O4
C. 1mol酞最多与2molNaOH发生反应 D. 酚酞分子与苯酞互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子RO3n-中共有x个核外电子,R原子的质量数A,则R原子核内含有的中子数是( )
A.A-x+n+48B.A-x-n-24C.A-x+n+24D.A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中化学教材中“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是
①检验自来水中是否含氯离子 ②鉴别食盐和纯碱 ③检验鸡蛋壳能否溶于酸 ④除去热水瓶中的水垢
A.①②③④B.②③④C.②④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.(配制酸性KMnO4标准溶液)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。

(1)请你观察图示判断其中不正确的操作有____(填序号)。
(2)其中确定50 mL溶液体积的容器是____(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测的实验结果将_______(填“偏大”或“偏小”)。
II.(测定血液样品中Ca2+的浓度)抽取血样20. 00 mL,经过上述处理后得到草酸,再用0.020 mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)已知草酸与酸性KMn04溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O,则式中的x=____。
(5)滴定时,根据现象____,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为____mg.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
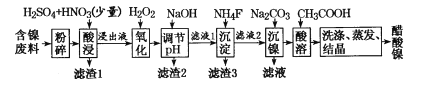
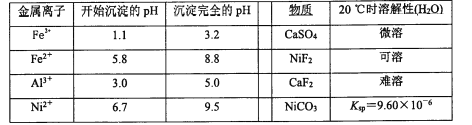
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
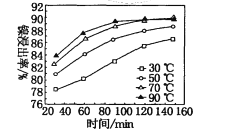
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. ![]() =1×10-13 mol·L-1的溶液中:NH
=1×10-13 mol·L-1的溶液中:NH![]() 、Ca2+、Cl-、NO
、Ca2+、Cl-、NO![]()
B. 使酚酞变红色的溶液中:Na+、Al3+、SO![]() 、Cl-
、Cl-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D. 水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO![]() 、CO
、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
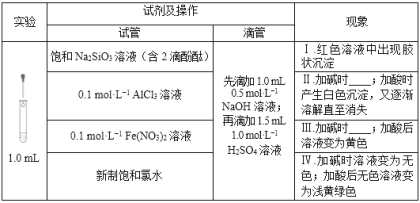
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_____________。
(2)Ⅱ中加碱时出现的现象是_______________,此现象说明溶液中发生反应的离子方程式是____________________________________。
(3)Ⅲ中加碱时出现的现象是_____________________________________。
(4)用离子方程式解释Ⅳ中加碱时出现的现象:____________________________________。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
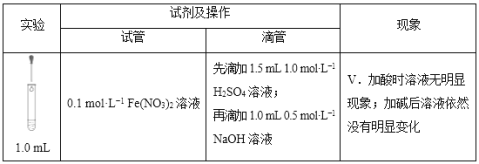
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1mol/LFe(NO3)2溶液中______________,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol/LFe(NO3)2溶液中的Fe2+被NO3-氧化;
b.______________________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com