��2013?����һģ���Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO
2��H
2��Ӧ��ȡ��
2CO
2��g��+6H
2��g��?CH
3CH
2OH��g��+3H
2O��g����H��0����ش�
��1���ں��¡����ݵ��ܱ������У�����������˵��������Ӧ�Ѵﻯѧƽ��״̬����
bde
bde
������ĸ��ţ���
a������1mol CH
3CH
2OH��ͬʱ������3mol H
2O
b����ϵ�и���ݵ����ʵ���Ũ�Ȳ���ʱ����仯
c����ϵ�л��������ܶȲ���ʱ����仯
d����ϵ������ķ�����������ʱ����仯
e����ϵ�е��������ѹǿ����ʱ����仯
��2��������Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽΪ
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
�����¶�T
1��T
2ʱ����ѧƽ�ⳣ��K
1��
��
K
2�����������������=������
��3���ں��¡�����̶���ij�ܱ������м���2mol CO
2��6mol H
2���ﵽƽ�����CH
3CH
2OHΪ0.5mol����H
2��ת����Ϊ
50%
50%
������������������1mol CO
2��3mol H
2��ƽ�����
�����ƶ�
�����ƶ�
��������ƶ������������ƶ������ƶ��������ٴδﵽƽ��ʱ��CO
2��ת���ʻ�
����
����
�����������С�����䡱����
��4���ڹ�ҵ�����У���ʹH
2��ת���ʺͻ�ѧ��Ӧ����ͬʱ��ߵĴ�ʩ��
����CO2Ũ�Ȼ�����ѹǿ
����CO2Ũ�Ȼ�����ѹǿ
��д��һ��������ʩ���ɣ���
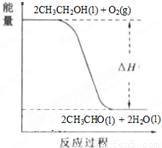
��5����֪��0.5mol �Ҵ�Һ��ȼ�����ɶ�����̼��ˮ�������ų�������Ϊ617.1kJ/mol����֪H
2O��l���TH
2O��g����H=+44.2kJ/mol����д���Ҵ�Һ����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ
C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.8kJ/mol
C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.8kJ/mol
��

 ��
�� ��
��



 ��2012?����ģ�⣩�Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO2��H2��Ӧ�Ƶã�2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��g����H��0
��2012?����ģ�⣩�Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO2��H2��Ӧ�Ƶã�2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��g����H��0 �Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO2��H2��Ӧ��ȡ��
�Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO2��H2��Ӧ��ȡ��