
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的 吸收。
A.浓H2SO4 B. 氨水 C.NaOH溶液 D.稀HNO3
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,检验溶液中还存
在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,
下列说法正确的是 。
a.粗铜接电源正极,发生氧化反应 b.溶液中Cu2+向阳极移动
c.利用阳极泥可回收Ag、Pt、Au等金属 d.电能全部转化为化学能
(5)利用反应2Cu+H2O2+H2SO4==CuSO4+2H2O可制得CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
科目:高中化学 来源: 题型:
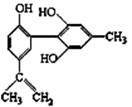
有机物A的结构简式如右图所示,下列有关说法正确的是
A.该物质的分子式为C16H14O3
B.可用酸性KMnO4溶液证明其结构中存在碳碳双键
C.1 mol该物质分别与浓溴水和H2反应,最多消耗Br2 和H2分别
为4 mol、7 mol
D.该分子最多有15个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
Ag2 Se单晶呈六角微型管状,有望开发为新型材料,其制取原理为:
4AgCl+3Se +6NaOH 2Ag2Se+ Na2SeO3+4NaCl+3H2O关于该反应下列叙述正确的是( )
A.AgCl作氧化剂
B.6mol NaOH参加反应转移6mol e-
C.氧化剂与还原剂的质量比为1:2
D.被还原的元素与被氧化的元素的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1mol·L-1的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)
的值增大,可以采取的措施是 ( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是( )
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
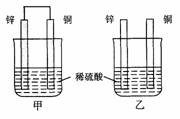
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH4+ 所含质子数为10NA
B.16克臭氧中所含原子数约为NA
C.1mol氯气被氢氧化钠溶液完全吸收,转移的电子数为2NA
D.标准状况下,44.8L水中所含的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
2.8g Fe全部溶于一定浓度200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液中c(H+ )=0.1mol·L-1 。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中存在Fe3+和Fe2+ B.1.12L气体是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol·L-1 D.反应后的溶液最多还能溶解1.4gFe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com