
【题目】用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
A.干燥的
B.瓶塞不漏水的
C.用欲配制的溶液润洗过的
D.以上三项均须要求的
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥ CaSiO3
A.①③ B.②④ C.②③④ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时,天津港国际物流中心区域内化学危险品仓库因起火而发生爆炸。其仓库存储的桶装氰化钠,因爆炸冲击发生了泄漏。氰化钠是一种重要的基本化工原料,用于电镀、冶金等,因此很多工业废水中也含氰化钠,此工业废水可与其他工业废水一同处理。下图是工业上处理含铬废水和含氰废水的流程图:
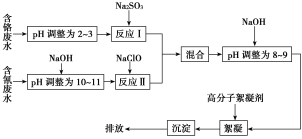
(1)含铬废水中的铬元素主要以CrO![]() 形式存在,酸化时CrO
形式存在,酸化时CrO![]() 可转化为Cr2O
可转化为Cr2O![]() ,现象是__________________________。
,现象是__________________________。
(2)酸性条件下,Cr2O![]() 极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
(3)①在爆炸发生时有少量氰化钠炸出,有人指出可用双氧水处理,使之被氧化成无毒物质,已知二者反应生成一种烘焙时常用的物质,并释放出一种有刺激性气味的气体,该气体易液化,液化后常用作制冷剂,请写出氰化钠与过氧化氢反应的化学方程式:________________________。
②除双氧水外,还可用硫代硫酸钠处理氰化钠,转化为Na2SO3及弱毒性的NaSCN,写出两种物质发生反应的化学方程式:__________________。
(4)pH>10时,“反应Ⅱ”中的NaClO可将氰离子(CN-)快速氧化为两种无毒的物质,写出该反应的离子方程式:_____________________________。
(5)经过“反应Ⅰ”和“反应Ⅱ”的两种废水“混合”的目的是____________________。
向混合后的溶液中加NaOH调为碱性的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
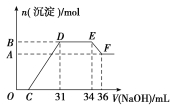
A.OC段离子反应方程式为:H++OH-===H2O
B.溶液中n(NH![]() )=0.012 mol
)=0.012 mol
C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgSO4、 MgCl2这三种盐配成的混合溶液中,若Na+ 的浓度为0.1mol/L、Mg2+的浓度为0.25mol/L、Cl-的浓度为0.2mol/L,则SO42-的物质的量浓度为( )
A.0.5molL-1 B.0.45molL-1 C.0.2molL-1 D.0.25molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法正确的是
A. 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
B. 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂
C. 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿
D. 为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5molL﹣1的盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是( )
A.0.05 molL﹣1
B.0.25 molL﹣1
C.0.10 molL﹣1
D.0.50 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是
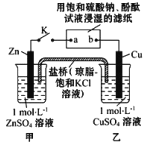
A.片刻后甲池中 c(SO42-)增大 B.电子沿 Zn→a→b→Cu 路径流动
C.Cu 电极上发生还原反应 D.片刻后可观察到滤纸 b 点变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com