
【题目】一定条件下,在水溶液中1 mol ClOx-(x=0,1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
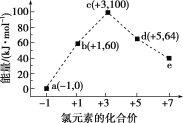
A.e是ClO3-
B.b→a+c反应的活化能为60 kJ·mol-1
C.a、b、c、d、e中c最稳定
D.b→a+d反应的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq) ΔH=-116 kJ·mol-1
【答案】D
【解析】
从图中可知,各微粒中氯元素的化合价:a为-1价,b为+1价,c为+3价,d为+5价,e为+7价。根据氧化还原反应写出b→a+c和b→a+d的离子反应方程式。
A选项,根据图可知e对应的价态为+7价,因此该离子为ClO4-,故A错误;
B选项,b→a+c即2ClO-(aq)= Cl-(aq)+ClO2-(aq) ΔH=(100 kJ·mol-1+0 kJ·mol-1)2×60 kJ·mol-1 = 20 kJ·mol-1,该反应为放热反应,但无法知道该反应的活化能,故B错误;
C选项,根据能量越低越稳定,a、b、c、d、e中a能量最低,所以a最稳定,故C错误;
D选项,b→a+d反应的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq) ΔH=(64kJ/mol+2×0kJ/mol)3×60kJ/mol=116kJ/mol,为放热反应,反应物的键能之和小于生成物的键能之和,故D正确;
综上所述,答案为D。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的气体产物,某同学选用了如图所示的实验装置。下列说法错误的是
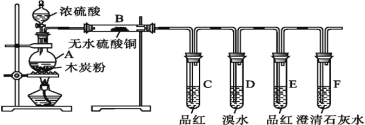
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.D装置中溴水褪色,则说明SO2具有漂白性
D.F装置用来检验产物中是否有CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产含氯有机物时会产生HCl。
利用反应__HCl(g)+__O2(g)__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。_____
(2)若将该反应设计成一原电池,则Cl2应在_____(填“正极”或“负极”)附近逸出。
(3)上述反应中所有元素原子半径由大到小的顺序为_____;与氯元素同族的短周期元素原子最外层电子排布式为____。
(4)判断氯、溴非金属性强弱的依据是____(选填序号)。
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是__(选填序号)。
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.![]() =K
=K
(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为___。
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线(![]() =1,2,4,6)
=1,2,4,6)

①曲线a对应的投料比![]() ____。
____。
②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有____;____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3﹣甲基﹣2﹣丙基﹣1﹣戊烯结构简式为_____________;
(2)丙烯制备聚丙烯化学方程式:__________________;
(3)2-甲基-1,3-丁二烯与Br2的1,4-加成反应化学方程式__________________;
(4)![]() 名称为:_____________;
名称为:_____________;
(5)反-2-丁烯 ___________________________
(6)有机物A只由C,H,O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-O-H和位于分子端的C、H,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1.
①写出A的分子式___________;
②写出A的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 氦气含有的质子数为
氦气含有的质子数为![]()
B.1mol氯气与足量的铁反应,转移电子数目为3NA
C.![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]()
D.密闭容器中![]() 与
与![]() 充分反应,产物的分子数为
充分反应,产物的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如下图所示的转化关系:
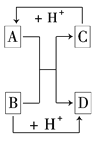
(1)如果A、B、C、D均是10电子的粒子,请写出:
A的电子式_____________;D的电子式____________;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式:____________________________________
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会祥云火炬的主要燃料为丙烷,下列关于丙烷的说法正确的是
A.丙烷分子中3个碳原子在一条直线上
B.丙烷可以与溴水发生取代反应
C.丙烷在空气中燃烧只可能生成CO2和H2O
D.常温常压下,22g丙烷所含氢原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
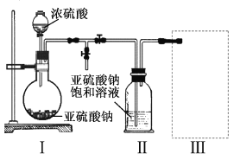
实验一焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:
Na2SO3+SO2=Na2S2O5
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 。(填序号)。
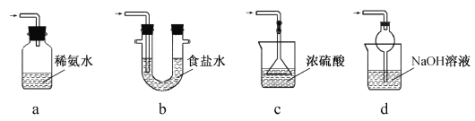
实验二焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:馏分中的二氧化硫在滴入碘水时发生的反应为
SO2+I2+2H2O=H2SO4+2HI)在测定时消耗了0.01mol·L-1的I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列五个反应
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
E.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
上述反应中氯元素只被氧化的是_____________,(填字母,下同)只被还原的是_____________,部分被氧化的是_____________,C中被氧化与被还原的物质的量之比为_____________。
(2)在反应4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反应中,若产生2mol N2,转移电子数为_________(用NA表示阿伏加德罗常数);用“双线桥”表示反应中电子转移,化合价的变化,反应类型:______________。
(4)将等质量的两份镁、铝合金分别投入足量的NaOH和HCl中,在相同的情况下测得生成气体的体积之比为1:2,求合金中镁、铝的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com