
����Ŀ����������±ʯ��K2SO4MgSO42CaSO42H2O������������������ˮ�д�������ƽ��
K2SO4MgSO42CaSO42H2O��s��2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
Ϊ�ܳ�����ü���Դ���ñ���Ca��OH��2��Һ�ܽ���±ʯ�Ʊ�����أ�����������ͼ1��
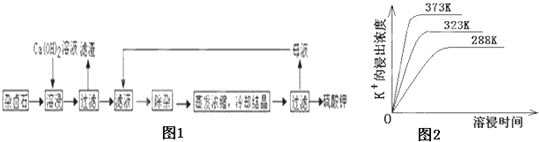
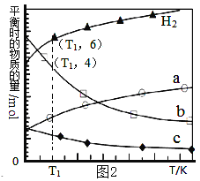
��1��������Ҫ�ɷ���__________��___________�Լ�δ����±ʯ��
��2���û�ѧƽ���ƶ�ԭ������Ca��OH��2��Һ���ܽ���±ʯ����K+��ԭ��_______________��
��3���������������У��ȼ���_______��Һ��������Ȳ������ˣ��ټ���________��Һ����ҺPH�����ԣ�
��4����ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ��ͼ2����ͼ�ɵã������¶����ߣ���__________________________��______________________________��
��5�������Կ�����̼����Ϊ�ܽ��������ܽ������лᷢ����CaSO4��s��+![]() CaCO3��s��+
CaCO3��s��+![]()
��֪298Kʱ��Ksp��CaCO3��=2.80��10��9��Ksp��CaSO4��=4.90��10��5������¶��¸÷�Ӧ��ƽ�ⳣ��K_____________��������������λ��Ч���֣���
���𰸡�CaSO4 Mg��OH��2 ��������þ���ӽ��ʹƽ�������ƶ��������ӱ�� K2CO3 H2SO4 ��ͬһʱ��K+�Ľ���Ũ�ȴ� ��Ӧ���ʼӿ죬ƽ��ʱ�ܽ�ʱ��� 1.75��104
��������
��1���������̺���ȡĿ�ģ����������������ˮ�д��ڵ�ƽ����������뱥��Ca��OH��2��Һ��ƽ���Ӱ������жϣ�
��2�������������ƺ�ƽ��״̬�µ�þ���ӽ������������þ�������ٽ�ƽ�����Ʒ�����
��3��������������������Ҫ�dz�ȥ�����ӣ������������µ����ʣ�������ҺPH�����ԣ���ȥ�����̼��أ��õ��ϴ���������أ���Ҫ����������ڣ�
��4������ͼ��������������壬���ߵı仯���ﵽƽ����Ҫ��ʱ������жϣ�
��5���Կ�����̼����Ϊ�ܽ��������ܽ������лᷢ����CaSO4��s��+CO32����aq��CaCO3��s��+SO42����aq��ƽ�ⳣ������д������ʽ����������ơ�̼����ܶȻ������ļ������ʽ��ת����ϵ�и�������ͬ�������
��1��������������ˮ�д��ڳ����ܽ�ƽ�⣺K2SO4MgSO42CaSO42H2O��s��2Ca2++2K++Mg2++4SO42��+2H2O��Ϊ�ܳ�����ü���Դ���ñ���Ca��OH��2��Һ�ܽ���±ʯ�Ʊ�����أ����������Ӻ�þ���ӽ������������þ������ͬʱ���������࣬��������Ƴ�����������������Ҫ�ɷ�ΪCaSO4��Mg��OH��2���ʴ�ΪCaSO4��Mg��OH��2��
��2��Ca��OH��2��Һ���ܽ���±ʯ����K+��ԭ�������������DZ�����Һ����������������Ӻ�þ���ӽ������������þ�������ٽ�ƽ�����Ƹ��������࣬������Һ�������������ƣ�����K+���ʴ�Ϊ��������þ���ӽ��ʹƽ�������ƶ��������ӱ�ࣻ
��3����������������Ҫ�dz�ȥ�����ӣ����ݳ���ԭ���������µ����ʣ�������ȡ��Ŀ�����Ʊ�����أ����Լ�����Լ����ڳ�ȥ���������µ����ʣ���˼������K2CO3�������ӣ����˺�������������ԣ���ȥ̼��أ��ʴ�ΪK2CO3��H2SO4��
��4��������ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ���¶�Խ��K+�Ľ���Ũ��Խ���ܽ�ʱ��Խ�̣���Ӧ����Խ�ﵽƽ��Խ�죬��ͼ���з����õ��Ľ���Ϊ���¶�Խ�ߣ���ͬһʱ��K+�Ľ���Ũ�ȴ�Ӧ���ʼӿ죬ƽ��ʱ�ܽ�ʱ��̣�
�ʴ�Ϊ��ͬһʱ��K+�Ľ���Ũ�ȴ�Ӧ���ʼӿ죬ƽ��ʱ�ܽ�ʱ��̣�
��5���ܽ������лᷢ����CaSO4��s��+CO32����aq��CaCO3��s��+SO42����aq����CaCO3��s��=Ca2++CO32����CaSO4��s��=Ca2++SO42������������ơ�̼����ܶȻ������ļ������ʽ��ת����ϵ�и�������ͬ���㣬��Ӧ��ƽ�ⳣ��K= =
=![]() =
=![]() =1.75��104���ʴ�Ϊ1.75��104��
=1.75��104���ʴ�Ϊ1.75��104��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У���ӦaA��g��![]() bB��g����ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����
bB��g����ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����
A.ƽ�����淴Ӧ�����ƶ���
B.����A��ת���ʼ�С��
C.����B����������������
D.a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����������ͼ��ʾװ����ȡ���ռ���������ش��������⣺
(1)ԭ���뷽��
����ȡ�����Ļ�ѧ����ʽΪ__________________________________��
�ڸ��ռ������ķ���Ϊ________��
A�������ſ����� B�������ſ�����
(2)װ�������
����ͼ��װ����������ʵ�顣����a������Ϊ____________��

(3)˼���뽻��
������ȡ��״����4.48 L NH3��������ҪNH4Cl________g��
��ʵ������ȡ���������ɲ�����ͼ�е�______(�A����B��)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2 )�ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH 3OH(g)+H2O(g) ��H2
CH 3OH(g)+H2O(g) ��H2
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
��֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O |
| H��O | C��H |
E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
�ش��������⣺
��1��CH3OH���������ڱ���λ��___������___��Ԫ�أ�����ͬ������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ___����Ԫ�ط��ű�ʾ������ԭ����___��
��2��д��CH3OH�Ľṹʽ___����Ӧ�ٵ��Ȼ�ѧ����ʽ(�����þ�����ֵ��ʾ)___��
��3������H2=-58kJ mol-1�����H3=__kJ mol-1��
��4��CO��H2�Ļ�������ֳ�ˮú��������ˮ��ú��һ�������²�����д���÷�Ӧ�Ļ�ѧ����ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ������к͵ζ����ⶨ���۰״�������[(g��(100 mL)-1]��
����ʵ�鲽��
��1����___(����������)��ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
��2������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2�η�̪��ָʾ����
��3����ȡʢװ0.1000mol��L-1NaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ___mL��
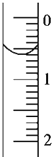
��4���ζ�����___ʱ��ֹͣ�ζ�������¼ NaOH��Һ���ն������ظ��ζ�3�Ρ�
����ʵ���¼
����� | 1 | 2 | 3 | 4 |
V(��Ʒ)(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(����)(mL) | 15.95 | 15.00 | 15.05 | 14.95 |
�������ݴ���������
��1����ͬѧ�ڴ�������ʱ����ã�ƽ�����ĵ�NaOH��Һ�����V��![]() mL��15.24mL����ָ������㲻����������ȷ���ݴ������ɵ����۰״���������____g����100mL��-1��
mL��15.24mL����ָ������㲻����������ȷ���ݴ������ɵ����۰״���������____g����100mL��-1��
��2���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����___��д���)��
a����ʽ�ζ����ڵζ�ʱ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L�������������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽ�ͷ�Ӧ��ʼ��2 minĩZ��ƽ����Ӧ���ʷֱ�Ϊ��������
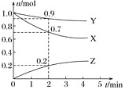
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����n mol AlCl3����Һ�м���m mol NaOH��Һ���۲쵽�����������а�ɫ�������ɣ����ܽ⣬������Al(OH)3���������ʵ����ǣ� ��
A.(4n-m)molB.(4m-n)molC.(n-3m)molD.(3m-n)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ͼ��ʾ��U�ι���ʢ��100mL����Һ����Ҫ��ش��������⣺

��1����K2 ���ϲ�K1 ������ʢ��ҺΪCuSO4��Һ�� B���ĵ缫��ӦʽΪ ______
��2����K1���ϲ�K2������ʢ��ҺΪ���з�̪��KCl��Һ�����ܷ�Ӧ��ѧ����ʽ�� __________________��
��3����Ӧһ��ʱ����K2,��������Һ������仯��������ܽ⣬B������������������״����Ϊ11.2mL������Һ��ֻ�ϣ���������Һ��pHԼΪ ________����Ҫʹ�������Һ�ָ���ԭ״̬������U�ι��ڼ����ͨ��һ������ __________��
��.CO��;�㷺����ҵӦ��ʱ�벻��ƽ��˼���ָ������ijһ�ݻ�Ϊ5L�����������ܱ������ڣ�����0.3 mol ��CO��0.3mol��H 2O���ڴ������ں�800��������¼��ȣ��������·�Ӧ��CO��g��+H20��g��![]() CO2��g��+H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�������ͼ��
CO2��g��+H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�������ͼ��

��1������ͼ�����ݣ����¶ȣ�800�棩�µ�ƽ�ⳣ��K=____________________________��
��2�����������������£��ı�����������ʹƽ�ⳣ��K�������______________������ĸ��
A.�����¶� B.�����¶� C.����ѹǿ D.��Сѹǿ E.������� G.�Ƴ�һ����̼����
��3���������¶Ⱥ�������������䣬�ڣ�1��������ƽ����ϵ�У��ٳ���0.3mol��ˮ���������´ﵽƽ���H2O��ת����______________������������������������������������
��4���ڴ�����800��������£���ijһʱ�̲��c��CO��=c��H2O��= 0.09mol��L��1��c��CO2��=c��H2��= 0.13 mol��L��1�����ʱ�����淴Ӧ���ʵĴ�С������_________����������>������<������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
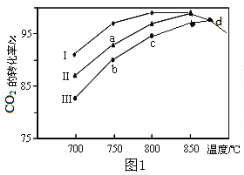
����Ŀ��������̼�IJ����������������ҹ���Դ�����һ����Ҫս�Է���չ��һ����Ҫ�����˲�ҵ��
��1����֪��CH4��CO��H2��ȼ���ȷֱ�Ϊ890kJ��mol-1��283kJ��mol-1��285.5kJ��mol-1���������з�Ӧ�ķ�Ӧ�ȣ�CO2(g)+CH4(g)=2CO(g)+2H2(g) ��H��___kJ��mol-1��
��2�����÷����е�CO2Ϊԭ����ȡ�״�����Ӧ����ʽΪ��CO2+3H2![]() CH3OH+H2O����������ͬ���ü״��ϳɷ�Ӧ�ڲ�ͬ������I��II��III�������·�Ӧ��ͬʱ���CO2��ת�����淴Ӧ�¶ȵı仯��ͼ1��ʾ��
CH3OH+H2O����������ͬ���ü״��ϳɷ�Ӧ�ڲ�ͬ������I��II��III�������·�Ӧ��ͬʱ���CO2��ת�����淴Ӧ�¶ȵı仯��ͼ1��ʾ��
�ٸ÷�Ӧ�ġ�H__0����������������������
��d�㲻ͬ������I��II��III��������CO2��ת������ͬ��ԭ����___��
��3���ö�����̼���������ϳɵ�̼ϩ������ʼʱ��0.1MPa��n(H2)��n(CO2)=3��1��Ͷ�ϱȳ��뷴Ӧ���У�������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ2��ʾ��
C2H4(g)+4H2O(g) ��H����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ2��ʾ��
�ٸ÷�Ӧ��___�Է����У�������������������������
��b������������___��
��T1�¶��µ�ƽ��ת����Ϊ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com