
����Ŀ����ʹ������к͵ζ����ⶨ���۰״�������[(g��(100 mL)-1]��
����ʵ�鲽��
��1����___(����������)��ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
��2������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2�η�̪��ָʾ����
��3����ȡʢװ0.1000mol��L-1NaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ___mL��
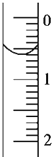
��4���ζ�����___ʱ��ֹͣ�ζ�������¼ NaOH��Һ���ն������ظ��ζ�3�Ρ�
����ʵ���¼
����� | 1 | 2 | 3 | 4 |
V(��Ʒ)(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(����)(mL) | 15.95 | 15.00 | 15.05 | 14.95 |
�������ݴ���������
��1����ͬѧ�ڴ�������ʱ����ã�ƽ�����ĵ�NaOH��Һ�����V��![]() mL��15.24mL����ָ������㲻����������ȷ���ݴ������ɵ����۰״���������____g����100mL��-1��
mL��15.24mL����ָ������㲻����������ȷ���ݴ������ɵ����۰״���������____g����100mL��-1��
��2���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����___��д���)��
a����ʽ�ζ����ڵζ�ʱ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
���𰸡���ʽ�ζ���(��10mL��Һ��) 0.60 ��Һ����ɫǡ�ñ�Ϊdz��ɫ�����ڰ�����ڲ���ɫ 4.5 b
��������
����1���״ijɷ���CH3COOH������ʽ�ζ�����ȡ��
��3������ͼƬ������
��4����̪��ָʾ�����ﵽ�ζ��յ�ʱ����Һ����ɫǡ�ñ�Ϊdz��ɫ��
����1���ɱ��������ݿ�֪��һ���������ϴ����������������������ݽ��м��㣻
��2������c(����)=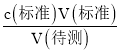 �������
�������
����1���״ijɷ���CH3COOH��Ӧ������ʽ�ζ�����ȡ��
��3���ɵζ������ݿ�֪��Һ������Ϊ0.60mL��
��4����̪��ָʾ�����ﵽ�ζ��յ�ʱ����Һ����ɫǡ�ñ�Ϊdz��ɫ�����ڰ�����ڲ���ɫ��
����1���ɱ��������ݿ�֪��һ���������ϴ�����������NaOH��Һ��ƽ�����V��![]() mL��15.00mL����10mL�״���Ʒ�к���CH3COOH x g����CH3COOH��NaOH��֪x=
mL��15.00mL����10mL�״���Ʒ�к���CH3COOH x g����CH3COOH��NaOH��֪x=![]() =0.45g�����100mL����Ʒ�к��д��������Ϊ0.45g��
=0.45g�����100mL����Ʒ�к��д��������Ϊ0.45g��![]() =4.5g�������۰״���������4.5g��(100mL)-1��
=4.5g�������۰״���������4.5g��(100mL)-1��
��2��a.��ʽ�ζ����ڵζ�ʱ�ñ�NaOH��Һ��ϴ������������ȷ����Ӱ��ζ������a�����
b. ��ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ��ʹV(��)ƫ������ҺŨ��ƫ�ߣ�b����ȷ��
c. ��ƿ�м������״���Һ���ټ�����ˮ����V(��)��Ӱ�죬��ҺŨ�Ȳ��䣬c�����
d. ��ƿ�ڵζ�ʱ����ҡ����������Һ�彦��������Һ�����ʵ���ƫС������V(��)ƫС����ҺŨ��ƫ�ͣ�d�����
��ѡb��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�

�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ��̽��̼��ŨH2SO4��Ӧ�IJ����ŨH2SO4��ľ̿��Ӧ�����������������ʵ�飺
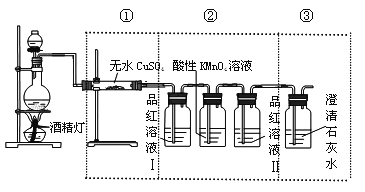
(1)����ͨ����ˮ����ͭ�����������˵�������к���__________��
(2)����ͨ��Ʒ����Һ����Һ��ɫ���ȣ���Һ�ָ���ɫ��˵�������к���__________(����SO2������CO2��)��
(3)����ͨ�������ij���ʯ��ˮ��������ɫ��������С����Ϊ�����к���CO2������Ϊ�ý��ۣ�__________(������ȷ����������ȷ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������еĵ�����������ɴ�����Ⱦ����Ҫ���ء�
��1��NOx������β������Ҫ��Ⱦ��֮һ����������������ʱ������N2��O2��Ӧ���������仯ʾ��ͼ���£�
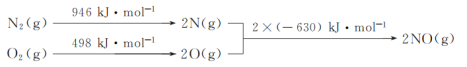
��N2(g)��O2(g)��Ӧ����NO(g)���Ȼ�ѧ��Ӧ����ʽΪ___��
��2������ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ�����������Ҫ���⡣ij�о�С����ʵ������Ag��ZSM��5Ϊ���������NOת��ΪN2��ת�������¶ȱ仯�����ͼ1��ʾ��
������ʹ��CO���¶ȳ���775 K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ_____��
��NOֱ�Ӵ��ֽ�(����N2��O2)Ҳ��һ������;�����ڲ�ͬ�����£�NO�ķֽ���ﲻͬ���ڸ�ѹ�£�NO��40���·ֽ��������ֻ������ϵ�и�������ʵ�����ʱ��仯������ͼ2��ʾ����д��NO�ֽ�Ļ�ѧ����ʽ��______��

��3��һ�������£���NOx/O3������м���һ��Ũ�ȵ�SO2���壬����ͬʱ��������ʵ�飬ʵ������ͼ3��
��ͬʱ��������ʱNO���������Ե͵�ԭ����____��
����ͼ3��֪SO2��NO��������Ӱ���С��ԭ����_____��
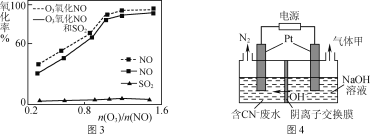
��4����������������з������������еĵ�������Ի�������Ⱦ������Ȼ���е�CH4��H2�Ȼ�ԭSO2���Ӳ����з����һ�ֺ�����������ԼΪ94%�Ļ�����������ֻ���������ԭNOx����д�����ֺ������NOx��Ӧ�Ļ�ѧ����ʽ��_____��
��5��ij��ҵ��ˮ�к��ж��Խϴ��CN�������õ�ⷨ����ת��ΪN2��װ����ͼ4��ʾ������������N2�ĵ缫��ӦʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�����ϩ������ķ�Ӧװ����ͼ��ʾ���й���Ϣ���£�
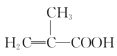 +CH3OH
+CH3OH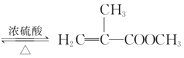 +H2O
+H2O

��֪����ϩ����������ۺϣ�����ϩ�����������Һ���ܽ�Ƚ�С��CaCl2���봼����γɸ����
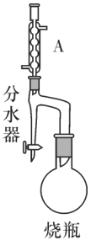
ʵ�鲽�裺
����100mL��ƿ�����μ��룺15mL����ϩ�ᡢ2����ʯ��10mL��ˮ�״���������Ũ���
���ڷ�ˮ����Ԥ�ȼ���ˮ��ʹˮ���Ե��ڷ�ˮ����֧�ܿڣ�ͨ������ˮ������������ƿ���ڷ�Ӧ�����У�ͨ����ˮ���²��������ֳ����ɵ�ˮ�����ַ�ˮ����ˮ��Һ��ĸ߶Ȳ��䣬ʹ�Ͳ㾡���ص�Բ����ƿ�У�
�۵�____��ֹͣ���ȣ�
����ȴ�����Լ�Xϴ����ƿ�еĻ����Һ�����룻
��ȡ�л�����Һ���õ��ϴ����ļ���ϩ�������
��ش��������⣺
��1��Aװ�õ�������__��
��2���뽫�����������__��
��3������ʵ��������ɵĸ�����ṹ��ʽΪ__(������)��
��4������˵����ȷ����___(����ĸ����)��
A.�ڸ�ʵ���У�Ũ�����Ǵ�������ˮ��
B.������Ӧ�������ɵ������ܶȱ�ˮ�����÷�ˮ����߷�Ӧ���ת����
C.ϴ�Ӽ�X��һ���Լ�������Ҫ�����ñ���Na2CO3������CaCl2��Һϴ��
D.Ϊ����������ٶȣ����һ������ɲ��ü�ѹ���ò���һ�������ó�ѹ����
��5��ʵ������ռ���ˮ���������ˮ�����������Ϊ2.70g���������ϩ������IJ���ԼΪ__(�������һλС��)��ʵ���м���ϩ�������ʵ�ʲ�������С�ڴ˼���ֵ��������ԭ����__(����ĸ����)��
A.��ˮ���ռ���ˮ�ﺬ����ϩ�����
B.ʵ�������·�������Ӧ
C.��Ʒ����ʱ�ռ����ֵͷе�����
D.��Ʒ��ϴ�ӡ���������������ʧ.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������±ʯ��K2SO4MgSO42CaSO42H2O������������������ˮ�д�������ƽ��
K2SO4MgSO42CaSO42H2O��s��2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
Ϊ�ܳ�����ü���Դ���ñ���Ca��OH��2��Һ�ܽ���±ʯ�Ʊ�����أ�����������ͼ1��
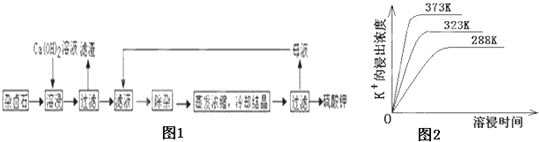
��1��������Ҫ�ɷ���__________��___________�Լ�δ����±ʯ��
��2���û�ѧƽ���ƶ�ԭ������Ca��OH��2��Һ���ܽ���±ʯ����K+��ԭ��_______________��
��3���������������У��ȼ���_______��Һ��������Ȳ������ˣ��ټ���________��Һ����ҺPH�����ԣ�
��4����ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ��ͼ2����ͼ�ɵã������¶����ߣ���__________________________��______________________________��
��5�������Կ�����̼����Ϊ�ܽ��������ܽ������лᷢ����CaSO4��s��+![]() CaCO3��s��+
CaCO3��s��+![]()
��֪298Kʱ��Ksp��CaCO3��=2.80��10��9��Ksp��CaSO4��=4.90��10��5������¶��¸÷�Ӧ��ƽ�ⳣ��K_____________��������������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��N2(g)��3H2(g) ![]() 2NH3(g) ��H��0��2SO2(g)��O2(g)
2NH3(g) ��H��0��2SO2(g)��O2(g)![]() 2SO3(g) ��H��0����ش��������⣺
2SO3(g) ��H��0����ش��������⣺
(1)��Ӱ�컯ѧ��Ӧ���ʺͻ�ѧƽ������ط�����Ҫ������NH3��SO3�����ɣ�������Ӧ��ȡ�Ĵ�ʩ��_______��ʵ�������в�ȡ�Ĵ�ʩ��_________��
(2)�ںϳɰ��Ĺ�ҵ�����У�Ҫ���������Ŀ����__________�����ϳ�SO3�Ĺ����У�����Ҫ�����SO3��ԭ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������ʹ����ƻ����Һ��c(CH3COOH)��c(CH3COO��)����֮��Ϊ0.1 mol��L��1��ͬʱ��Һ��c(CH3COOH)��c(CH3COO��)��pHֵ�Ĺ�ϵ��ͼ��ʾ�������й�������ȷ���ǣ� ��

A.pH5.75��pH3.75����Һ�о����ϣ�c(Na��)��c(H��)��c(CH3COO��)��c(OH��)
B.����Ũ�ȹ�ϵ 2c(Na��)��c(CH3COO��) ��c(CH3COOH)����Һ��Ӧͼ��W��
C.pH��5.75��Һ�У�c(CH3COOH)>c(Na��)>c(CH3COO��)>c(H��)>c(OH��)
D.����ͼ�����ݣ����ܼ����25 ��ʱ����ĵ���ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuCl����ʰ�ɫ���۵�Ϊ430�����е�Ϊ1490��������ֽ⣬¶���ڳ�ʪ�������ױ�������������ˮ��ϡ���ᡢ�Ҵ���������Ũ��������H3CuCl4����Ӧ�Ļ�ѧ����ʽΪCuCl��s��+3HCl��aq��H3CuCl4��aq����
��1��ʵ��������ͼ1��ʾװ����ȡCuCl����Ӧԭ��Ϊ��
2Cu2++SO2+8Cl��+2H2O�T2CuCl43��+SO![]() +4H+
+4H+
CuCl43����aq��CuCl��s��+3Cl����aq��
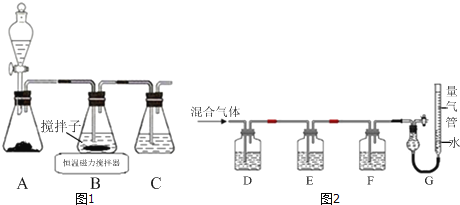
��װ��C��������_____��
��װ��B�з�Ӧ������ȡ������������ͼ��ʾ�������õ�CuCl���壮
�����![]()
![]()
![]()
![]()
![]() CuCl����
CuCl����
����������ҪĿ����_____
�����������ѡ�õ��Լ���_____��
��ʵ���ұ�������CuCl����ķ�����_____��
�����ᴿij����ͭ�۵�CuCl���壬�����ʵ�鷽����_____��
��2��ijͬѧ������ͼ2��ʾװ�ã��ⶨ��¯ú����CO��CO2��N2��O2�İٷ���ɣ�
��֪��
i��CuCl��������Һ������CO�γ�Cu��CO��ClH2O��
ii�����շۣ�Na2S2O4����KOH�Ļ����Һ������������
��D��Fϴ��ƿ����ʢ�ŵ��Լ��ֱ���_____��_____��
��д�����շۺ�KOH�Ļ����Һ����O2�����ӷ���ʽ��_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com