
【题目】25 ℃时,醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)二者之和为0.1 mol·L-1,同时溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关叙述正确的是( )

A.pH5.75和pH3.75的溶液中均符合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.存在浓度关系 2c(Na+)=c(CH3COO-) +c(CH3COOH)的溶液对应图中W点
C.pH=5.75溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.根据图中数据,不能计算出25 ℃时醋酸的电离平衡常数
【答案】A
【解析】
根据图象可看出,浓度增大的曲线应为c (CH3COO-) ,浓度减小的曲线应为c (CH3COOH),W点时c (CH3COOH) =c (CH3COO-);
A、根据电荷守恒;
B、由图可知,W点所表示的溶液中c (CH3COOH) =c (CH3COO-)=0.05mol/L,根据W点溶液的pH进行判
断;
C、由图可知,pH=4.75时,c (CH3COOH) =c (CH3COO-)=0.05mol/L, pH=5.75时,酸性减弱,溶液中醋酸的电离程度增大,故溶液中c (CH3COOH)减小,溶液中c (CH3COO-)减小,据此确定c (CH3COOH)和c (CH3COO-)的相对大小;
D、根据电离平衡常数公式解答。
A、溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B、W点时溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时 c(CH3COO-)=c(CH3 COOH),所以2c(Na+)+2c(H+) -c(OH-)=c(CH3COO-)+c(CH3 COOH),此时溶液呈酸性,所以2c(Na+)<c(CH3COO-) +c(CH3COOH),故B错误;
C、pH= 5.75的溶液中:c(H+)> c(OH-),根据电荷守恒c(CH3COO-)> c(Na+),由图可知,pH=4.75时,c (CH3COOH) =c (CH3COO-)=0.05mol/L,pH=5.75时,酸性减弱,溶液中醋酸的电离程度增大,故溶液中c (CH3COOH)减小,溶液中c (CH3COO-)增大,c (CH3COOH)<c (CH3COO-),所以离子浓度大小的顺序为c(CH3COO-) >c(CH3COOH)>c(Na+) >c(H+)>c(OH-),故C错误;
D、 W点c(CH3COO-)=c(CH3 COOH),平衡常数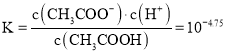 ,故D错误;
,故D错误;
故选A。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量[(g·(100 mL)-1]。
(Ⅰ)实验步骤
(1)用___(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。
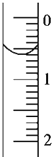
(4)滴定。当___时,停止滴定,并记录 NaOH溶液的终读数。重复滴定3次。
(Ⅱ)实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品)(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗)(mL) | 15.95 | 15.00 | 15.05 | 14.95 |
(Ⅲ)数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=![]() mL=15.24mL,乙指出其计算不合理。按正确数据处理,可得市售白醋总酸量=____g·(100mL)-1;
mL=15.24mL,乙指出其计算不合理。按正确数据处理,可得市售白醋总酸量=____g·(100mL)-1;
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)。
a.碱式滴定管在滴定时用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含n mol AlCl3的溶液中加入m mol NaOH溶液,观察到的现象是先有白色沉淀生成,后部分溶解,则生成Al(OH)3沉淀的物质的量是( )
A.(4n-m)molB.(4m-n)molC.(n-3m)molD.(3m-n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:

(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液: B极的电极反应式为 ______
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的KCl溶液,则:总反应化学方程式是 __________________。
(3)反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,常温下溶液的pH约为 ________。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 __________。
Ⅱ.CO用途广泛,工业应用时离不开平衡思想的指导:在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)![]() CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:

(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂和800℃的条件下,在某一时刻测得c(CO)=c(H2O)= 0.09mol·L-1;c(CO2)=c(H2)= 0.13 mol·L-1,则此时正、逆反应速率的大小:υ正_________υ逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:

(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
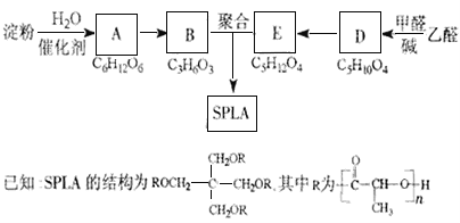
(1)淀粉是____________糖(填“单”或“多”);A的名称是_______。
(2)乙醛由不饱和烃制备的方法之一是_______________________(用化学方程式表示,可多步)。
(3)D![]() E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1mol G与足量Na反应生成1mol H2,则G的结构简式为______。
(5)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com