
【题目】某气态烃甲在标准状况下的密度为1.25gL-1,在一定条件下氧化可生成有机物乙;乙与氢气反应可生成有机物丙,乙进一步氧化可生成有机物丁;丙和丁在浓硫酸加热条件下可生成有机物戊(有芳香气味)。

请回答:
(1)甲的结构简式是_____________;乙的官能团名称为__________________;
(2)写出丙和丁反应生成戊的化学方程式_______________________________;
(3)下列说法正确的是___________
A.有机物甲可以使高锰酸钾溶液褪色,是因为发生了氧化反应
B.葡萄糖水解可生成有机物丙
C.有机物乙和戊的最简式相同
D.有机物戊的同分异构体有很多,其中含有羧基的同分异构体有3种
【答案】CH2=CH2 醛基 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。 AC
CH3COOC2H5+H2O。 AC
【解析】
某气态烃甲在标准状况下的密度为1.25gL-1,根据ρ=M/Vm,所以M=ρVm=1.25gL-1×22.4L/mol=28g/mol,气态烃的碳原子数小于等于4,故甲是C2H4,乙烯催化氧化生成乙醛, 乙醛和氢气反应生成乙醇,乙醛催化氧化生成乙酸,乙酸和乙醇酯化反应生成乙酸乙酯。
(1)某气态烃甲在标准状况下的密度为1.25gL-1,根据ρ=M/Vm,M=ρVm=1.25gL-1×22.4L/mol=28g/mol,气态烃的碳原子数小于等于4,故甲是C2H4,乙烯催化氧化生成乙醛,故答案为:CH2=CH2;醛基。
(2)乙与氢气反应可生成有机物丙,丙是乙醇,乙进一步氧化可生成有机物丁,丁是乙酸,
丙和丁在浓硫酸加热条件下可生成有机物戊(有芳香气味),戊是乙酸乙酯,反应的化学方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O ,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O ,故答案为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
(3)A.甲是乙烯,乙烯可以使高锰酸钾溶液褪色,乙烯被高锰酸钾溶液氧化了,故A正确;
B. 葡萄糖不能水解,故B错误;
C. 乙是乙醛,分子式是C2H4O,戊是乙酸乙酯,分子式是C4H8O2,最简式都是C2H4O,故C正确;
D. 有机物戊的同分异构体,其中含有羧基的同分异构体有2种,故D错误。
故选AC。


科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是( )

A. V(NaOH)=10 mL时,溶液中存在c(Na+)=2c(H2T)+2c(HT-)+2c(T2-)
B. V(NaOH)=20mL时,溶液中存在c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-)
C. V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D. V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA
B. 1 L 0.1 mol·L1的NaHCO3溶液中![]() 和
和![]() 离子数之和为0.1NA
离子数之和为0.1NA
C. 在一定温度下64gSO2与足量氧气充分反应,转移电子数为4NA
D. 含有NA个Fe( OH)3胶粒的氢氧化铁胶体中,铁元素的质量大于56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用15.8g高锰酸钾氧化密度为1.19g/cm3、质量分数为36.5%的盐酸以制取氯气。反应如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积?____
(2)求盐酸的浓度?____
(3)如果恰好完全反应,求所需盐酸的体积?____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的工作原理:Zn+2MnO2+2H2O![]() 2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1x)Fe2O4,其工艺流程如图所示:
2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1x)Fe2O4,其工艺流程如图所示:

(1)已知MnxZn(1x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________。
(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________。
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:______________________、_______。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L1,c(Fe2+)+c(Fe3+)=b mol·L1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为___________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+ 氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________。
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷的某种合成原料由C、H、O三种元亲组成,其球棍模型如图所示。

下列说法正确的是
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物能发生水解反应,不能发生加聚反应
D. 该化合物的链状同分异构体中,能与 NaHCO3反应放出CO2的只有3种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是
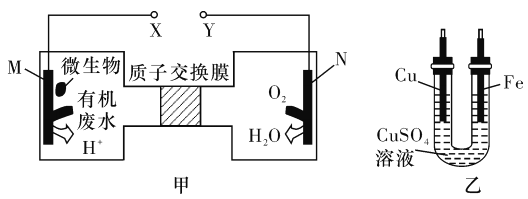
A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2L H2O含有的分子数为0.5NA
B.46g NO2和N2O4的混合物含有的原子数为3NA
C.20g NaOH固体溶于1L 水可制得0.5mol/L的NaOH溶液
D.同温同压下,体积相同的氢气和氩气所含的原子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com